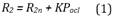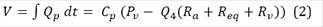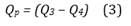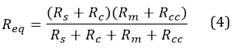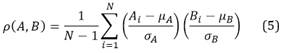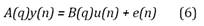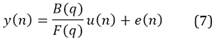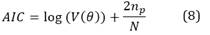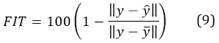Introducción
Las enfermedades cardiovasculares (ECV) constituyen una de las causas más importantes de discapacidad y muerte prematura en todo el mundo; en 2012 murieron por esta causa 17,5 millones de personas, correspondiente al 31% de todas las muertes registradas1.
Actualmente, las estrategias preventivas contra las ECV son el centro de interés en las investigaciones médicas2. En diversas investigaciones se ha evidenciado que el deterioro de la función vascular es el paso inicial en el desarrollo de complicaciones cardiovasculares2-4, por tanto, es importante que, como primer paso en la detección o evaluación de riesgo de las ECV, se evalúe la reactividad vascular (RV).
Los estudios de la función vascular se conocen como pruebas de RV5; los cuales pueden ser un método efectivo para diagnosticar el daño vascular. La RV medida en una arteria es extrapolable a la de otras arterias en el mismo sujeto6; con base en esta premisa, la técnica más usada para estudiar la RV es medir la respuesta hiperémica después de una isquemia producida por oclusión arterial4,5.
Un método estándar para la evaluación de la función vascular es la dilatación mediada por flujo (FDM, por sus siglas en inglés) de los vasos, basada en el efecto de vasodilatación que produce el incremento del flujo sanguíneo, y se mide el cambio máximo porcentual en el diámetro arterial, mediante imágenes de ultrasonido de alta resolución7. Una de las limitaciones del método es la dependencia de las habilidades del operador que captura la imagen de la arteria y el alto costo del equipo de ultrasonido de alta resolución. Por lo tanto, se han realizado esfuerzos para evaluar el estado vascular durante la hiperemia reactiva (HR) mediante técnicas menos dependientes del operador y menos costosas.
Ante esta situación han surgido nuevas técnicas diagnósticas que evalúan RV mediante HR en una extremidad5,8-14, las cuales buscan un promisorio avance en la detección temprana de las ECV, sin embargo estos métodos se encuentran en estado de desarrollo y requieren validación y aceptación clínica.
Actualmente, el Grupo de Investigación en Bioinstrumentación e Ingeniería Clínica, GIBIC, en asocio con el Grupo de Investigación en Fisiología y Bioquímica, PHYSIS, de la Universidad de Antioquia, investigan sobre una técnica para evaluar la función vascular mediante los cambios de color de las manos durante la HR. El resultado entregado por el dispositivo está compuesto de tres curvas por cada componente de color, que relacionan la mano control respecto a su contralateral ocluida, antes, durante y después de la isquemia inducida. Aun cuando se puede inferir que el cambio de color de la mano con el vaso ocluido está relacionado con los cambios en la perfusión sanguínea, interesa entender con mayor detalle los cambios ocurridos en la vasculatura durante la HR y su relación desde el punto de vista fisiológico con los cambios de color observados.
Una alternativa para lograr este entendimiento es el modelado computacional y para tal fin se propone como hipótesis de trabajo, que es posible modelar computacionalmente la mecánica vascular y el proceso asociado de cambios de coloración en las palmas de las manos durante la HR. Un modelo de estas características permitiría identificar qué parámetro mecánico de la vasculatura varía cuando se detectan cambios específicos de coloración en la palma de las manos.
Un estudio de la extremidad superior de la mano y el proceso de oclusión fue implementado por Goldoozian et al.15, quienes aplicaron un modelo agrupado desde el extremo de la aorta ascendente hasta la microvasculatura del pulpejo dactilar; donde cada segmento vascular fue modelado mediante un circuito eléctrico RLC (resistencia, inductor y capacitor). El brazalete de oclusión fue implementado mediante un interruptor (SW), en el que la posición abierta del SW representa la oclusión del brazo. La salida del modelo es el volumen periférico durante todo el proceso de HR. La ventaja de este es que se ha utilizado previamente para modelar diferentes mecanismos reguladores incluyendo la función endotelial16,17.
En este artículo se presenta la modificación del modelo de la vasculatura previamente reportado en la literatura, que permite establecer la relación entre el volumen periférico y los cambios de color
de las manos antes, durante y después de la oclusión arterial. Para tal fin se presenta la modificación del modelo, las técnicas de identificación empleadas, los resultados obtenidos y posteriormente se discute su utilidad frente a los procesos de validación de técnicas de estimación de la RV.
Materiales y métodos
Modelo computacional
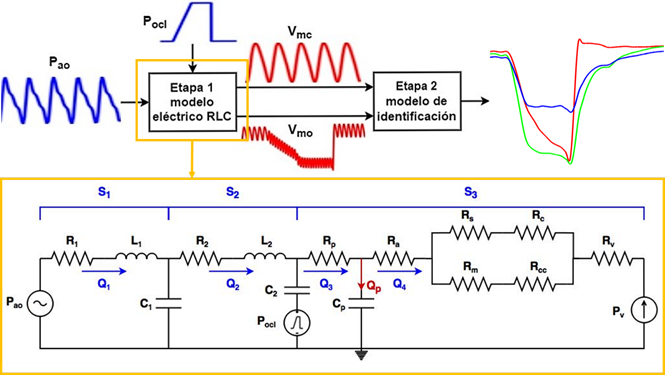
El modelo propuesto está compuesto por dos etapas, la primera es una modificación del modelo de predicción implementado por Goldoozian et al.15, y la segunda es el modelo resultante del proceso de identificación propuesto en este artículo. En la figura 1 se presenta el esquema general en donde se pueden ver cuáles son las entradas y salidas de cada subsistema.
Figura 1. Arriba: Esquema general del modelo propuesto. Abajo, ampliación del recuadro naranja: Analogía eléctrica de la extremidad superior con el brazalete de oclusión. Modificación propuesta para el modelo de Goldoozian et al.15 con el fin de simular oclusión con brazalete. Pao presión en la aorta, Pocl presión de oclusión, Vmc volumen periférico de la mano control, Vmo volumen periférico de la mano ocluida, R1 resistencia de la aorta ascendente, L1 inercia de la aorta ascendente, C1 distensibilidad de la aorta ascendente, R2 resistencia del brazo, L2 inercia del brazo, C2 distensibilidad del brazo, Rp resistencia de las arterias terminales, Cp distensibilidad de las arterias terminales, Ra resistencia de las arteriolas grandes, Rm y Rs resistencia de las arteriolas pequeñas, Rc y Rcc resistencia de los capilares, Rv resistencia de las vénulas, y Pv la presión a la entrada venosa.
Primera etapa: Modelo eléctrico RLC
Corresponde al propuesto por Goldoozian et al.15, donde las ecuaciones resultan del análisis de circuitos aplicados a la analogía eléctrica del sistema vascular de la extremidad superior; cada segmento arterial fue modelado como un vaso cilíndrico con paredes viscoelásticas no extensible en la dirección longitudinal18, mediante un circuito eléctrico RLC. El parámetro R describe la resistencia al flujo que percibe la sangre, C se refiere a la distensibilidad de la arteria, y L representa la inercia de la sangre; además la presión (P) sería análoga al voltaje y el flujo sanguíneo (Q) a la corriente eléctrica15,19.
La señal de entrada al sistema está dada por la presión en la aorta (Pao). Pao es obtenida mediante una serie de Fourier que reconstruye la forma de onda de la presión sanguínea en función del tiempo, la frecuencia cardiaca, la presión arterial sistólica (Psis), presión arterial diastólica (Pdia) y la presión de pulso20. Los valores simulados de Psis/Pdia fueron 80/120 mmHg. Así mismo, la frecuencia cardiaca fue de 70 veces por minuto en condiciones de reposo21.
La modificación propuesta al modelo de Goldoozian et al.15, en la ampliación del recuadro naranja, donde S1 corresponde el segmento desde la aorta ascendente hasta la posición del brazalete, S2 modela el resto del brazo hasta la entrada periférica y S3 es la red periférica (Figura 1).
La modificación permite representar la acción del brazalete de oclusión, a través del cambio en el tiempo de la resistencia del brazo (R2) mediante una señal de oclusión (Pocl) multiplicado por un factor K. También el nivel de referencia de la distensibilidad del brazo (C2) se ve afectada por Pocl. La señal de Pocl fue modelada con una señal rampa, que comienza a incrementar en el momento de inicio de la oclusión hasta alcanzar un valor de 20 mmHg por encima de la Psis, sosteniendo este último valor hasta la liberación del brazalete, y retorna a cero. Mientras Pocl se encuentra en cero, R2 es igual al valor nominal (R2n) y el circuito se comporta como el sistema presentado por Goldoozian et al.15. La ecuación que describe el comportamiento de R2 para simular presiones aplicadas por el brazalete se da en la siguiente expresión:
Los valores de los elementos eléctricos del modelo de la Figura 1 (ampliación del recuadro naranja) dependen de las propiedades reológicas de la sangre, los parámetros geométricos y mecánicos del segmento del vaso, y el número de vasos16,17. Los valores nominales de cada elemento eléctrico del modelo son: resistencia de la aorta ascendente (R1) igual a 1.26k mmHg.s.l-1, inercia de la aorta ascendente (L1) igual a 27 mmHg.s2.l-1, distensibilidad de la aorta ascendente (C1) igual a 66.67μ l.mmHg-1, resistencia del brazo (R2n) igual a 3.17k mmHg.s.l-1, inercia del brazo (L2) igual a 369 mmHg.s2.l-1, distensibilidad del brazo (C2) igual a 6𝜇 l.mmHg-1, resistencia de las arterias terminales (Rp) igual a 17.73k mmHg.s.l-1, distensibilidad de las arterias terminales (Cp) igual a 4.8𝜇 l.mmHg-1, resistencia de las arteriolas grandes (Ra) igual a 40.2k mmHg.s.l-1, resistencia de las arteriolas pequeñas (Rm, Rs) igual a 701.03k mmHg.s.l-1, resistencia de los capilares (Rc, Rcc) igual a 3.195k mmHg.s.l-1, y resistencia de las vénulas (Rv) igual a 27.9k mmHg.s.l-1. La presión Pv corresponde a la entrada venosa y se estableció en 8 mmHg, de acuerdo con el rango de valores fisiológicos15-17.
La salida entregada por el modelo es el volumen periférico, calculado a partir de la integral del flujo periférico Qp (Figura 1). Las ecuaciones del modelo fueron implementadas en Matlab(r) y Simulink(r). El modelo es simulado en dos ocasiones, la primera para obtener la señal de volumen periférico de la mano control (Vmc) con la Pocl en cero, y en la segunda para registrar la señal de volumen periférico para la mano ocluida (Vmo) con Pocl en funcionamiento. Las ecuaciones (2), (3) y (4) obtenidas a partir del modelo, calculan dichos volúmenes periféricos.
Donde:
El volumen V depende de Q3 y Q4, y estos a su vez se ven afectados por el funcionamiento de Pocl. Mientras Pocl está en cero, V se comporta como Vmc y cuando Pocl se encuentra activa, V es igual a Vmo.
Para identificar el valor del parámetro K en la ecuación 1, se implementó un proceso de identificación con el fin de ajustar la salida de la primera etapa del modelo a una señal de presión adquirida experimentalmente.
Segunda etapa: Modelo de identificación
El modelo que relaciona los cambios de volumen vascular (perfusión sanguínea) con los cambios de color de las palmas de la mano, corresponde a un problema de identificación de tipo caja negra, en donde solo son conocidas las señales de entrada y salida del modelo. Vmc y Vmo (volumen en la microvasculatura de las manos, sin oclusión y con oclusión, respectivamente) calculadas a partir de la simulación de la primera etapa y corresponden a las entradas de esta etapa.
Las salidas del sistema dependen de la técnica implementada para realizar la medida de RV. En este caso se trata de la comparación del cambio de coloración de las dos manos y para tal fin, la forma más sencilla de identificar un cambio de coloración es utilizar la correlación cruzada entre los cambios de color en las tres componentes Rojo, Verde y Azul (RGB, por sus siglas en inglés). Es así, como cada secuencia de imágenes capturada por una cámara son desagregadas en sus componentes de color y posteriormente se calcula la correlación entre los tres pares de secuencias (mano ocluida y mano control), utilizando el coeficiente de correlación lineal de Pearson22, así:
Donde A y B son dos variables aleatorias, N es el número de observaciones, μA y σA son la media y la desviación estándar de A, y μB y σB son la media y la desviación estándar de B, respectivamente.
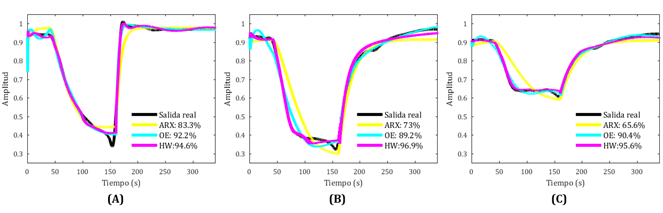
Dado que el coeficiente de Pearson calculado con la ecuación (5) cambia para cada par de imágenes, se obtiene una serie de coeficientes para cada componente de color que describe el cambio de coloración. Cada una de las tres curvas de cambio de color corresponde a una señal de salida del sistema de caja negra, de tal forma que se cuenta con tres curvas de salida que representan el cambio de la mano ocluida con respecto a su bilateral control, durante el proceso de hiperemia reactiva (antes, durante y después de la oclusión de la arteria braquial).
Datos experimentales
Con el propósito de validar los resultados de la etapa 2 (Figura 1), es decir, las curvas de cambio de color, se realizó una prueba experimental de medición de la RV con el equipo desarrollado por el grupo de investigación, dicha prueba forma parte de un estudio descriptivo. El estudio se realizó en un sujeto sano sin problemas de presión arterial, sin enfermedad cardiovascular evidente, sin obesidad, y que no consume medicamentos que puedan afectar al sistema cardiovascular. El día de la prueba, el voluntario no realizó ejercicio, no fumó, y no consumió cafeína ni alcohol. Para el momento de la prueba, el sujeto se presentó con las manos limpias, sin accesorios en los dedos, en estado de reposo y sin agitación.
Una vez dispuesto un brazalete de oclusión en el brazo del sujeto, y ubicadas las manos en posición de pronación sobre la superficie de grabación, se inició el registro del video de la palma de ambas manos con la cámara. Luego de transcurridos 40s en los cuales se tomó una línea de base del video, se generó un estímulo isquémico mediante la oclusión de la arteria braquial por medio del inflado del brazalete, calculando simultáneamente la presión Psis y Pdia, y manteniendo sostenida una presión de oclusión (Psis + 20 mmHg), por un tiempo máximo de dos min. Luego, la presión sostenida fue liberada inmediatamente, y como consecuencia se dio una respuesta hiperémica, debido a la recuperación de la isquemia, la cual fue grabada durante 3 min. En paralelo al proceso mencionado, se evaluaron los cambios de color en la palma de las manos control y prueba, antes, durante y después del estímulo isquémico inducido, comparando ambas manos mediante el coeficiente de correlación de Pearson y obteniendo como resultado curvas de cambio de color para cada espacio rojo, verde y azul, como se presenta en la salida de la etapa 2 (Figura 1).
Identificación paramétrica del sistema correspondiente a la segunda etapa
La identificación del sistema se realizó utilizando Matlab(r) mediante estructuras paramétricas que relacionan las señales de interés del sistema (entradas, salida y perturbaciones). La primera característica para identificar en el sistema es el orden del retardo (nk), que deberá corresponder a la situación física de interés, teniendo en cuenta que la frecuencia de muestreo es 21 Hz y que cambios en la presión de entrada deben producir cambios de color en la mano en cada latido, los retardos deberán estar alrededor de nk=21.
Se utilizaron estructuras de identificación lineales autorregresivas con entrada exógena (ARX, por sus siglas en inglés) y error en la salida (OE, por sus siglas en inglés) que se representan respectivamente por las siguientes expresiones23:
En las ecuaciones (6) y (7), la señal u(n) corresponde a las dos señales de entrada (Vmc y Vmo), A(q), B(q) y F(q) representan los polinomios de regresión de la salida y entrada. Los órdenes de dichos polinomios deberán permitir capturar la dinámica del sistema, por tal razón se prueban órdenes (na, nb, nf y nk) tales que, teniendo en cuenta la frecuencia de muestreo de los datos experimentales, sea posible representar la dinámica de la señal de salida. Después de una exploración de los datos experimentales, se encontró que órdenes inferiores a 30 permiten representar dichas señales.
El criterio usado para medir la calidad del modelo obtenido es conocido como el criterio de información de Akaike (AIC, por sus siglas en inglés), donde el modelo más preciso tiene el AIC más pequeño que se define como 24:
Donde
Es la función de pérdida, np es el número de parámetros en el modelo y N es el número de muestras de los datos.
La bondad de ajuste entre los datos experimentales y los predichos es calculado mediante el porcentaje de ajuste (FIT), como se presenta en la siguiente expresión23:
Donde 𝑦 es la señal de salida experimental, 𝑦 la salida predicha del modelo y 𝑦 es la media de 𝑦. Con el fin de verificar si asumir una estructura no lineal para esta etapa podría proporcionar mejores resultados, una vez identificado el mejor sistema lineal que reproduce las señales de salida, se procedió a la implementación de un modelo de identificación no lineal mediante la estructura Hammerstein-Weiner (HW)25,26 utilizando como componente lineal los polinomios del mejor modelo obtenido.
Esta estrategia de identificación proporcionará una estructura y sus órdenes respectivos por cada curva de color, es decir, tres modelos en total, cada uno con dos entradas y una salida (MISO, por sus siglas en inglés).