Introducción
El síndrome de resistencia a la insulina (RI) es actualmente uno de los factores etiológicos más importantes tanto de morbilidad, como de mortalidad a nivel mundial, debido a su asociación con obesidad, hipertensión arterial, dislipidemia, arteriosclerosis y el desarrollo de diabetes mellitus (DM) tipo 21. Las tasas de prevalencia global de RI, en estudios basados en población de niños y adolescentes, oscilan entre el 3,1 y el 44%2.
La RI se define como una reducción en la respuesta fisiológica de los tejidos a la acción de la insulina, particularmente a nivel del tejido muscular y adiposo. La insulina es una hormona anabólica secretada por las células β del páncreas en respuesta a diversos estímulos, siendo la glucosa el estímulo más relevante3. Su principal función es mantener la homeostasis glicémica y de otros sustratos energéticos. De esta forma, posterior a cada comida la insulina suprime la liberación de ácidos grasos libres mientras que favorece la síntesis de triglicéridos en el tejido adiposo. Por otra parte, inhibe la producción hepática de glucosa, mientras que promueve la captación de glucosa por el tejido muscular esquelético y adiposo4. En un estado de RI, la acción de esta hormona a nivel celular está reducida, aumentando la secreción de insulina. Esto permite compensar el defecto en la acción tisular y así mantener la homeostasis glicémica5. Este fenómeno da cuenta del estado hiperinsulinémico, el cual es característico en sujetos con RI. Se estima que aproximadamente el 55% de la variabilidad de la sensibilidad a la insulina en los niños está determinada por el contenido de tejido adiposo y el sexo6. La edad y el estadio puberal tienen un importante impacto en la distribución de la grasa y en la sensibilidad a la acción de la insulina7.
El incremento del depósito de grasa visceral es el principal factor independiente de riesgo en el desarrollo de estados de RI en niños y adolescentes8. La nutrición puede ser un factor favorecedor del desarrollo de RI. Así se ve favorecida por las dietas hipercalóricas con un elevado contenido de grasa y carbohidratos y con un bajo aporte de fibra9.
Hay un creciente reconocimiento de RI en la patogénesis de la diabetes tipo 2 en niños10. En poblaciones pediátricas obesas la existencia de RI puede ser el punto de partida para el desarrollo posterior de diabetes tipo 2 y/o síndrome metabólico11, habiéndose definido recientemente la prediabetes tipo 2 en el adolescente obeso12.
El aumento en la prevalencia de obesidad se ha visto acompañado de un incremento en la incidencia de diabetes tipo 2 en la población pediátrica13. El aumento del IMC en niños se asocia con mayor RI14. Las complicaciones metabólicas y cardiovasculares de la obesidad están estrechamente relacionadas con la presencia de hiperinsulinemia y de RI15. Dado el alarmante aumento de las tasas de obesidad entre los jóvenes, existe una gran preocupación de que la incidencia de diabetes sombreará esta tendencia. Lo que hace que la pandemia sea particularmente amenazante es que, en gran parte del mundo, permanece oculta (1 de cada 2 diabéticos están sin diagnosticar)16. Durante décadas, la glucosa, la hemoglobina A1c, la insulina y el péptido C han sido las pruebas de laboratorio de elección para detectar y vigilar la diabetes. Sin embargo, estas pruebas no identifican a los individuos prediabéticos o sus subfenotipos que están en riesgo de desarrollar DM tipo 2, este sería un requisito para la prevención individualizada17.
Los métodos diagnósticos disponibles para medir la sensibilidad a la insulina en la población pediátrica son: 1) el clamp hiperinsulinémicoeuglucémico, que representa el estándar de oro para medir la sensibilidad tisular a la insulina y la secreción de insulina aunque es de elevada complejidad18; 2) los índices de HOMA (Homeostasis Model Assessment)19 y QUICKI (Quantitative Insulin Check Index)20, que son los métodos más sencillos y los más utilizado para evaluar RI en el campo; y 3) el índice Matsuda-DeFronzo (también llamado ISI-Compuesto) que se calcula a partir de una curva de tolerancia a la glucosa oral (CTGO) de la cual se desprende información adicional sobre el metabolismo de la glucosa en el estado post-estimulatorio21.
La prueba de tolerancia oral a la glucosa sigue siendo el único medio para la identificación precoz y fiable de personas en la fase de prediabetes con alteración de la tolerancia a la glucosa. Este procedimiento, sin embargo, es muy largo y costoso y no es recomendable como método de cribado en una consulta médica. Por lo tanto, existe la necesidad de pruebas de laboratorio innovadoras para simplificar la detección precoz de las alteraciones en el metabolismo de la glucosa17. Las nuevas tecnologías para el diagnóstico, como la metabolómica, son herramientas sensibles, específicas y de gran utilidad frente a otras técnicas modernas, como la genómica.
El test Quantose TM IR (Metabolom INC, USA) es una prueba basada en la metabolómica para analizar la RI, capaz de generar un valor como indicador precoz de riesgo para el desarrollo de la prediabetes y la DM tipo 222. El α-hidroxibutirato es el metabolito más importante asociado con la sensibilidad a la insulina y es considerado un marcador precoz tanto para la RI como para la disglucemia, alteración de la regulación de la glucosa23.
Quantose TM IR es un análisis de sangre en ayunas que mide un panel de biomarcadores, que son reflejo de la RI. El panel de biomarcadores comprende un ácido orgánico (ácido alfa-hidroxibutírico), dos lípidos (ácido oleico y linoleoilglicerofosfocolina) y la insulina. La puntuación en la prueba fue desarrollada para estimar el valor obtenido del clamp euglucémico hiperinsulinémico, el estándar de oro para determinar la sensibilidad a la insulina, en un estudio prospectivo, observacional de 1277 personas clínicamente sanas, no diabéticas reclutadas en 13 países europeos22. El punto de corte en 63 fue definido por el tercil superior de puntuaciones en el estudio. Los niveles de insulina son medidos por inmunoquimioluminiscencia, y los 3 metabolitos son detectados por espectrometría de masas/cromatografía liquída (UHPLC LC-MS / MS). Las concentraciones de los 4 biomarcadores se combinan y analizan en un algoritmo que genera la puntuación de Quantose IR (escala 1-120).
La mayoría de los casos de DM tipo 2 pueden ser detectados y tratados oportunamente e invertir en nuevas tecnologías como método de prevención y detección precoz, puede reducir la carga mundial de diabetes y ahorrará miles de millones en pérdida de productividad y costes sanitarios16. Por lo anterior, este estudio tiene por objetivo comprobar la efectividad de un test metabolómico en la detección de marcadores de RI en población infantil.
Materiales y métodos
Estudio piloto descriptivo, transversal, ambispectivo, cuya población estuvo constituida por 11 niños (8 hombres, 3 mujeres) del servicio de pediatría del Hospital San Lorenzo del Escorial (Madrid) con factores de riesgo de complicaciones metabólicas (antecedentes familiares, obesidad, alteración e incremento de glucosa basal en plasma). La muestra fue incidental, pretendiendo tener una primera aproximación del uso (efectividad clínico-económico) de un test comercial, para la posible implementación futura en la práctica clínica.
Parámetros bioquímicos
Se extrajo sangre venosa en tubos EDTA vacutainer tras un periodo de 12 horas de ayuno de los sujetos. De esta forma se determinó la glucosa mediante el uso de un método de glucosa oxidasa automatizado (Roche Hitachi® 917, Roche Diagnostics, Mannheim, Alemania); insulina por radioinmunoensayo (RIA); hemoglobina glicada (HbA1c) por cromatografía liquida de alta precisión.
Se estableció como criterio diagnóstico para la prediabetes el estándar de la Asociación Americana de Diabetes24: la HbA1C de 5,7-6,4% y la glucosa basal 100-125mg/dl, es decir, superar o no superar esas cifras en alguno de los metabolitos clásicos.
Los criterios de inclusión fueron: Niños de 6 a 12 años, de ambos sexos, sin maduración sexual, con y sin obesidad o sobrepeso, con al menos dos factores de riesgo asociados a la RI (glucemias elevadas en sangre, herencia familiar, sobrepeso u obesidad).
Los criterios de exclusión fueron: Niños con maduración sexual en estadio de Tanner II o superior. Sujetos con diabetes tipo I, pancreatitis, hepatitis, parálisis cerebral, cáncer, enfermedades neuromusculares y psicológicas, u otras enfermedades graves. Sujetos con tratamiento farmacológico o suplemento dietético para el control de la glucemia.
Todos los participantes fueron invitados a participar durante un periodo de 3 semanas e informados de forma escrita y oral, sobre la finalidad del estudio. Los padres de aquellos que decidieron involucrarse firmaron una hoja de consentimiento informado, la cual detallaba los objetivos de la investigación, todos los procedimientos efectuados, la duración prevista de la misma, la falta de certeza sobre la seguridad y eficacia del tratamiento y los datos de los responsables de la investigación.
Del reclutamiento inicial de 15 sujetos, se excluyeron 4 participantes, 2 por no completar las pruebas, 1 por voluntad de los padres, y 1 por fallo en la determinación bioquímica en el laboratorio. Al tratarse de una muestra incidental desde la consulta hospitalaria y voluntaria, no se obtuvo un número equitativo por sexo ni edades.
Los datos fueron recogidos por dietistas-nutricionistas entrenados y formados, homogeneizando un protocolo de recolección de datos y monitorización del estudio. Se midió el peso (en kg), la talla (en m), el índice de masa corporal (IMC), el porcentaje de grasa corporal total, el porcentaje de grasa visceral, la masa libre de grasa (en kg) y el perímetro de cintura (en cm) de cada participante.
El peso, el IMC y la composición corporal se determinaron a través de una bioimepadancia eléctrica modelo Tanita BP601, tetrapolar, multifrecuencia, y una cinta métrica flexible, no elástica, metálica y de anchura inferior a 0,1mm-150cm. Para la realización de la bioimepadancia se siguió el protocolo estándar para este equipo25 y las recomendaciones del fabricante26. Dicho protocolo, fue comunicado previamente a los usuarios, para garantizar mayor fiabilidad del resultado.
Además, se realizó un cuestionario ad hoc que se diseñó con base en distintos cuestionarios que incluían datos personales, anamnesis clínica, hábitos de vida, ejercicio y alimentación, con el Cuestionario de Frecuencia de Consumo de Alimentos, suponiendo un tiempo aproximado de resolución entre 5 y 10 minutos.
Posteriormente, se realizó el test Quantose IR TM , mediante extracción de sangre, con el que se midió la concentración de cuatro metabolitos relacionados con la RI: alfa-hidroxibutirato, linoleo-glicerofosfocolina, ácido oleico e insulina, detectados por espectrometría de masas/cromatografía líquida (UHPLC LC-MS / MS). Estas mediciones cuantitativas absolutas se utilizan para generar una puntuación Quantose™ (escala 0-100), donde los valores superiores a 63 son indicativos de RI, y por tanto, prediabetes. La puntuación Quantose™ también se proporciona en una escala codificada con color. Cuando las puntuaciones Quantose™ cambian de valores menor a mayores, el color cambia de verde a naranja-rojo, lo que indica el cambio de un paciente sensible a la insulina a resistente a la insulina27.
El análisis de los datos se llevó a cabo con el programa de análisis estadístico SPSS 20, para los resultados de las mediciones cuantitativas de los 4 metabolitos se combinaron en un algoritmo de regresión logística para generar una puntuación Quantose™, que supera a otras estimaciones comúnmente utilizadas para la RI.
Resultados
La muestra estuvo constituida por 11 niños (8 hombres y 3 mujeres) con alto riesgo de diabetes. La edad media fue de 8,54 ± 3,53 años.
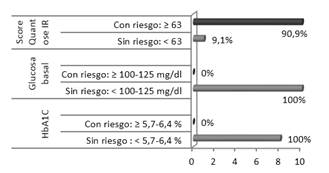
De los 11 sujetos, ninguno superó el criterio de la Asociación Americana de Diabetes para prediabetes (5,7-6,4 % HbA1C y 100-125 mg/dl glucosa basal): la media de la HbA1C fue 5,3 ± 0,19 % y de la glucosa 86,6 ± 5,6 mg/dl (Tabla 1).
Tabla 1. Análisis descriptivo de la muestra
Por el contrario el test de metabolómica Quantose IR © , detectó 10 sujetos con resistencia a insulina tras el análisis del algoritmo de los 4 metabolitos y el resultado de su score (>63), Quantose IR © : 78,09 ± 9,25 (Figura 1).
Discusión
Desafortunadamente, los métodos de detección generales para el descubrimiento de biomarcadores han tenido poco éxito. La metabolómica se está convirtiendo en una herramienta importante en el hallazgo de nuevos biomarcadores de diagnóstico y pronóstico28. Scalbert, et al.29, en su artículo sobre la identificación de biomarcadores en los que usó la metabolómica, incluye datos de apoyo sobre la validación de estos, sin embargo, la identificación de nuevos biomarcadores para detectar sujetos con riesgo de RI y para estratificar el riesgo de progresión a DM tipo 2 y/o enfermedad cardiovascular, con el fin de implementar estrategias efectivas para la prevención, así como para monitorizar la respuesta al tratamiento, sigue siendo una necesidad no satisfecha del todo28.
Gall et al.30 fueron los primeros en identificar como principal biomarcador de RI, el α-hidroxibutirato; y como segundo biomarcador más importante la linoleil glicerofosfocolina. Debido a que estos marcadores biológicos no habían sido evaluados previamente en estudios clínicos, probaron su capacidad para predecir la DM tipo 2 en una cohorte observacional a largo plazo de sujetos en situación de riesgo, concluyendo que los niveles de α-hidroxibutirato y linoleil glicerofosfocolina fueron predictivos de disglucemia.
Con base en los anteriores descubrimientos, se ha comprobado cómo Quantose TM es una prueba sencilla e innovadora para la RI basada en una única muestra de sangre en ayunas y puede tener valor como un indicador temprano de riesgo para el desarrollo de prediabetes y DM tipo 222. Los tres metabolitos utilizados en la prueba, ácido α -hidroxibutírico, ácido oleico y linoleil-glicerofosfocolina, tienen una serie de funciones potenciales en las vías metabólicas pertinentes a la acción de la insulina, la secreción de insulina y la función de las células β del páncreas22.
En el estudio de Cobb, et al.22, los tres biomarcadores de la prueba mostraron un patrón similar de diferencias significativas para los sujetos resistentes a la insulina. Los niveles de ácido α-hidroxibutírico y oleato aumentan en los sujetos resistentes a la insulina. Además, la puntuación Quantose™ es significativamente mejor para la detección de RI que la insulina sola (áreas bajo la cuerva de 0,79 vs. 0,74). A la hora de predecir la intolerancia a la glucosa, la puntuación Quantose™ también puede ser un indicador temprano. De hecho, la prueba identificó a los sujetos delgados en riesgo y con valores normales de glucosa en ayunas. La puntuaciones Quantose™ de los progresores a la intolerancia a la glucosa disminuyeron en un 8% en el transcurso de 3 años, indicando un incremento en la RI.
Ferrannini, et al.31, reportaron niveles progresivamente más elevados de α-hidroxibutírico y menores niveles de linoleil-glicerofosfocolina a través de los cuartiles de RI y en individuos con intolerancia a la glucosa o DM tipo 2. También demostraron dichos niveles al inicio del estudio en aquellos individuos con deterioro en comparación con una tolerancia estable a la glucosa después de 3 años de seguimiento y en aquellos individuos que progresan a DM tipo 2 después de 9,5 años de seguimiento. Cuando esto se añadió a un modelo para predecir la disglucemia o DM tipo 2, que incluía la historia familiar de diabetes, el sexo, la edad, el IMC, la glucosa en ayunas y los niveles en ayunas de estos dos metabolitos mejoraron la predictividad. Cuando el modelo incluía la glucosa en ayunas y a las 2 horas, los dos metabolitos tuvieron un impacto mínimo sobre la predictividad. Con estos resultados, Ferrannini et al.31, confirmaron que los niveles de α-hidroxibutírico y linoleil-glicerofosfocolina en ayuno pueden ser nuevos biomarcadores para ayudar a predecir la disglucemia y la DM tipo 2.
Conclusiones
Las pruebas basadas en la metabolómica podrían servir como un predictor temprano de la prediabetes o riesgo de DM tipo 2 en comparación con los marcadores tradicionales de glucemia (glucosa plasmática en ayunas, hemoglobina A1c, test de intolerancia oral a la glucosa), que aumentan relativamente tarde en la progresión de la enfermedad. A la luz de la actual pandemia mundial de diabetes tipo 2, tales acciones preventivas son sumamente importantes.
Actualmente se están analizando más resultados clínicos de diversas poblaciones longitudinales para demostrar el potencial clínico completo de este nuevo test de RI y prediabetes.
La metabolómica tiene el potencial de proporcionar información sobre las rutas importantes para el metabolismo de la glucosa y la patogénesis de la DM tipo 2. También puede dilucidar biomarcadores capaces de mejorar la predicción del riesgo de deterioro de la tolerancia a la glucosa y diabetes tipo 2. La puntuación del test Quantose™ podría ser una herramienta útil en la práctica clínica para el seguimiento personalizado de la progresión hacia la prediabetes o DM tipo 2 del paciente y, mejorar así potencialmente su estado glucémico.