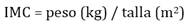Introducción
La prevalencia de la enfermedad pulmonar obstructiva crónica (EPOC) es variable, por ejemplo en Ciudad de México es del 7%, en Montevideo del 19%; y en Colombia el estudio PREPOCOL (Prevalencia de EPOC en Colombia) informó una prevalencia del 8,9%1. Según la iniciativa GOLD (Global Initiative for Chronic Obstructive Lung Disease), la EPOC es una enfermedad común, prevenible y tratable que se caracteriza por síntomas respiratorios persistentes y limitación del flujo aéreo debido a anomalías de las vías respiratorias y/o alveolares; generalmente causadas por una exposición significativa a partículas o gases nocivos2 No obstante la prevalencia de la EPOC, con frecuencia el diagnóstico se realiza en etapas tardías3.
El estado nutricional o el índice de masa corporal (IMC) afectan el curso y el pronóstico, la calidad de vida y la mortalidad, de los pacientes con EPOC4-6. En este grupo de pacientes, como en otros pacientes con enfermedades cardiovasculares, el IMC está inversamente relacionado con la calidad de vida4,7,8.
La gradación GOLD realiza una valoración integral del paciente con EPOC, considera la limitación al flujo de aire, el impacto sobre el estado de salud del paciente (síntomas respiratorios), y el riesgo de eventos a futuro, como exacerbaciones, clasifica al paciente en cuatro categorías, A, B, C y D, menor a mayor gravedad2.
Los estudios precedentes mostraron una asociación consistente entre la obesidad y las gradaciones I a IV de GOLD (valor aislado del VEF1) con las comparaciones con estadística paramétrica9-14. Sin embargo, los hallazgos de la asociación son divergentes o difíciles de interpretar en aquellos análisis realizados con una aproximación no paramétrica15-18.
En consecuencia, dada la reciente introducción de la nueva clasificación GOLD (evaluación combinada) se cuenta con un único estudio que muestra datos empíricos de la asociación de la frecuencia de exacerbaciones basada en esta clasificación y el IMC. Lambert, et al., compararon en el peso (normal o sobrepeso y las tres clases de obesidad) y observaron asociaciones que no siguieron un patrón ordinal. Los pacientes con peso normal o sobrepeso mostraron más en la evaluación GOLD en la A y C que los pacientes con cualquier clase de obesidad. Sin embargo, los pacientes con obesidad fueron con mayor frecuencia calificados en la evaluación B de GOLD que los pacientes con peso normal o sobrepeso15.
Sin duda, el conocimiento de la asociación entre el IMC y la nueva reagrupación de GOLD permitirá considerar el estado nutricional no sólo como un indicador de pronóstico general de la EPOC sino también en el proceso de rehabilitación para mejorar la funcionalidad y la calidad de vida de los pacientes19-20.
El objetivo de esta investigación fue cuantificar la asociación entre el IMC y la frecuencia de exacerbaciones en pacientes ambulatorios con EPOC en Santa Marta, Colombia.
Materiales y métodos
Diseño, población y muestra
Se diseñó un estudio cuantitativo, analítico, transversal. Se solicitó la participación de pacientes con EPOC atendidos en diferentes instituciones de Santa Marta. Se tomó una muestra no probabilística, por conveniencia, por la secuencia de atención, desde enero hasta mediados de diciembre de 2016. No obstante, se espera contar por lo menos con 267 pacientes, número de pacientes requeridos para una prevalencia esperada del 25% de exacerbaciones frecuentes (GOLD C y D), margen de error de 5 y nivel de confianza del 95%22. De la misma forma, este número de participantes permitía realizar el ajuste de este número de participantes hasta seis variables en bloque, bajo el principio de que contaron por lo menos 67 casos con exacerbaciones frecuentes, a la razón de 10 casos por cada variable de confusión23. Se incluyó pacientes mayores de edad atendidos en instituciones con servicio de consulta externa de neumología, independientemente de otra característica. Se excluyeron los pacientes que no completaron toda la evaluación.
Mediciones
Se tomaron los datos demográficos básicos además de peso, talla y frecuencia de exacerbaciones basadas en la clasificación de GOLD. El índice de masa corporal se calculó según la fórmula de Quetelet a partir del peso y altura (Fórmula 1)24.
Según el IMC los pacientes se categorizaron en cuatro grupos: Desnutrición: 18,4 kg/m2 o menos; saludable entre 18,5 y 24,9 kg/m2; sobrepeso entre 25,0 y 29,9 kg/m2; y obesidad: 30,0 kg/m2 o más.
Para precisar el diagnóstico de EPOC se consideró la presencia los síntomas clave como disnea, tos y producción de esputo en paciente con una función pulmonar sugestiva de la condición. Asimismo, se revisaron antecedentes de exposición al cigarrillo o humo de leña, en consonancia con la guía GOLD2. Las espirometrías se llevaron a cabo con el uso de un espirómetro (Master Screen PFT System de CareFusion ® - EU). La medición se realizó con los criterios y procedimientos recomendados por American Thoracic Society/European Respiratory Society (ATS/ERS) para la estandarización de la evaluación25.
La clasificación GOLD incluye los hallazgos en espirometría, la evaluación con el COPD Assessment Test (CAT) (EPOC por sus sigla en inglés) que aborda gravedad de síntomas y desempeño en actividades cotidianas y sociales y exacerbaciones2. Para analizar estas gradaciones se definieron dos grupos; menor frecuencia de exacerbaciones para las categorías A y B; y mayor frecuencia de exacerbaciones, C y D.
Los pacientes diagnosticados con EPOC, atendidos en los diferentes centros médicos fueron identificados e invitados a participar en el estudio. Posteriormente, los pacientes fueron evaluados todos en una de las instituciones por uno de los investigadores (JCPP). La evaluación incluyó completar los componentes de la iniciativa GOLD.
Análisis estadístico
Para el análisis descriptivo se frecuencias y porcentajes para los datos nominales y para datos cuantitativos, media y desviación estándar (DE). Se calcularon las razones de momios (OR), con los respectivos intervalos de confianza de 95% (IC 95%) para datos ordenados mediante regresión logística multinomial. Se tomó como independiente el IMC y como variable dependiente la frecuencia de exacerbaciones, menor y mayor número. Las asociaciones establecieron con el paquete IBM-SPSS Statistics versión 22.
Consideraciones éticas
Se contó la revisión y aprobación del comité de ética de la Facultad de Ciencias de la Salud de la Universidad del Magdalena. Los participantes firmaron consentimiento informado una vez conocieron los objetivos del estudio y que la participación no representaba un riesgo mayor para la integridad física y emocional que la revisión clínica rutinaria para la EPOC, todo en consonancia con la Resolución 8430 de 1993 del Ministerio de Salud21.
Resultados
Participaron 292 pacientes en edades entre 49 y 95 años (media=73,5; DE=8,7); 180 hombres (61,6%) y 112 mujeres (38,4%). Los IMC se observaron entre 12,8 y 40,2; media 24,2 (DE=4,5); en forma ordinal los pacientes se clasificaron de la siguiente manera: 21 (7,2%) con desnutrición; 153 (52,4%) con peso saludable; y 118 (40,4%) con sobrepeso u obesidad. Los pacientes con sobrepeso y obesidad se incluyeron en la misma categoría porque no se observó diferencia estadísticamente significativa entre los dos grupos en relación con la categoría GOLD, OR=1,4; IC95% 0,6-3,8.
Se contó mayor número de exacerbaciones (GOLD C y D) en 136 pacientes (46,6%) y menor frecuencia de exacerbaciones (GOLD A y B) en 156 (53,4%). El 85,7% de los pacientes con desnutrición presentaron mayor frecuencia de exacerbaciones comparado con el 51,6% en pacientes con peso saludable y 33,1% en pacientes con sobrepeso u obesidad. La diferencia fue estadísticamente significativa (Chi cuadrado=23,2; gl=2; p=0,001 y regresión multinomial, OR=0,18; IC95% 0,05-0,66 para peso saludable y OR=0,08; IC95% 0,02-0,29 para sobrepeso u obesidad frente a desnutrición).
Discusión
En la presente investigación se observa que el IMC o estado nutricional muestra una asociación inversa con la frecuencia de exacerbaciones en pacientes ambulatorios con EPOC en Santa Marta, Colombia. Este hallazgo es parcialmente congruente con lo observado en el estudio de Eriksson, et al., quienes mostraron que los pacientes con desnutrición fueron calificados GOLD 3-4, en la anterior versión de la gradación, que los pacientes con peso normal16. Sin embargo, esta observación es contraria a lo reportado por Lambert, et al., quienes mostraron que en conjunto los pacientes con mayor IMC (obesos) presentaron con mayor frecuencia clase GOLD D que los pacientes con peso normal o sobrepeso15. Por otro lado, McCormack, et al., observaron en una muestra de 84 pacientes que el IMC (peso normal y obesidad) no se asoció a la categoría GOLD17; esta independencia la replicaron también Koniski, et al., con una muestra de 996 pacientes, donde encontraron que el IMC no se relacionó significativamente con la clase GOLD18.
La inconsistencia en la asociación entre IMC y clasificación GOLD con el uso de estadística no paramétrica se puede explicar en gran parte por las características demográficas y clínicas de la población26. Asimismo, se debe considerar la línea de causalidad y tener presente que la asociación no necesariamente es causación27. Es posible que la pérdida de peso en pacientes con EPOC gradados en GOLD C y D sea en sí mismo un indicador de deterioro funcional y no la causa de éste, es decir, no es la falta de peso por pérdida de masa muscular o grasa corporal responsable del deterioro de la función pulmonar, el funcionamiento global y la mortalidad del paciente con EPOC6,19,28. De igual manera, considerar la naturaleza arbitraria de la clasificación GOLD que ha mostrado problemas por no seguir una secuencia lineal de menor a mayor frecuencia de exacerbaciones, A<B<C<D y las variaciones importantes que se dan en la clasificación según la escala usada para cuantificar los síntomas29,30.
Este trabajo tiene la ventaja de precisar la asociación entre el IMC y la frecuencia de exacerbaciones en pacientes con EPOC. No obstante, tiene la limitación de un tamaño de muestra reducido para ajustar la asociación entre IMC y la frecuencia de exacerbaciones por posibles variables de confusión como la edad26. Futuras investigaciones deben considerar este punto.