Carlos Alberto Gómez-Mercado1*b>orcid.org/0000-0003-4123-2812
Angela M. Segura-Cardona1 orcid.org/0000-0002-0010-1413
Dubán Enrique Pájaro-Cantillo1 orcid.org/0000-0002-3728-8699
Miler Mesa-Largo2 orcid.org/0000-0001-5177-6325
Fecha de recepción: Febrero 19 - 2019
Fecha de revisión: Julio 15 - 2019
Fecha de aceptación: Abril 30 - 2020
Introducción: En el mundo las leucemias agudas son los tumores más frecuentes en la edad pediátrica, de gran interés por sus implicaciones en el niño y su familia. Objetivo: Identificar la incidencia de leucemia linfoide aguda y su asociación con determinantes demográficos en pacientes con cáncer pediátrico, Antioquia, 2017. Materiales y métodos: Estudio observacional, descriptivo, transversal, retrospectivo con intención analítica, sobre la incidencia de leucemia linfoide aguda (LLA) y su asociación con determinantes demográficos no causales de pacientes con cáncer infantil, en 190 registros del Sistema de Vigilancia en Salud Pública (SIVIGILA). Resultados: Las tasas de incidencia de cáncer infantil y LLA fueron 10 casos y 4 casos por cada 100.000 habitantes ≤18 años respectivamente. Las variables asociadas a LLA son: ser hombre (RPa: 1,02 IC95%: 0,52 - 2,02), residencia rural (RPa: 1,59 IC95%: 0,55 - 4,56), afiliación al régimen subsidiado (RPa: 1,41 IC95%: 0,68 - 2,92), edad ≥ 9 años (RPa: 0,76 IC95%: 0,38 - 1,50) y oportunidad diagnóstica confirmatoria ≥ 16 días (RPa: 0,34 IC95%: 0,10 - 1,15). Conclusiones: Ser hombre, vivir en zona rural y estar afiliado al régimen subsidiado, está relacionado con la incidencia de leucemia linfoide aguda.
Palabras clave: Niños; cáncer; cáncer pediátrico; leucemia; leucemia linfoide aguda (Fuente: DeCS, Bireme).
Introduction: Acute leukemias are the most frequent pediatric malignancies worldwide that have led to a great interest due to their implications for children and their families. Objective: To identify the incidence of acute lymphocytic leukemia and its association with demographic determinants in pediatric cancer patients from Antioquia (Colombia) in 2017. Materials and methods: An observational, descriptive, cross-sectional, retrospective study was carried out with an analytical approach to identify the incidence of acute lymphocytic leukemia (ALL) and its association with non-causal demographic determinants in patients with pediatric cancer. 190 records from the Public Health Surveillance System (SIVIGILA) were analyzed. Results: The incidence rates of childhood cancer and ALL were 10 and 4 cases per 100,000 inhabitants ≤18 years of age, respectively. The variables associated with ALL are: being male (APR: 1.02 95% CI: 0.52 – 2.02); living in rural areas (APR: 1.59 95% CI: 0.55 – 4.56); being affiliated to the subsidized regime (APR: 1.41 95% CI: 0.68 – 2.92); being ≥ 9 years of age (APR: 0.76 95% CI: 0.38 – 1.50); and having a confirmatory diagnosis after 16 days (APR: 0.34 95% CI: 0.10 – 1.15). Conclusions: The variables related to acute lymphocytic leukemia are: being a man; living in rural areas; and being affiliated to the subsidized regime.
Key words: Children; cancer; pediatric cancer; leukemia; acute lymphoid leukemia (Source: DeCS, Bireme).
*Autor de correspondencia
Gómez-Mercado CA
e-mail: klargomez@gmail.com
Los tumores en la edad pediátrica son poco frecuentes, y representan aproximadamente del 1% al 3% de los tumores en población general(1), sin embargo, constituye una de las principales causas de muerte en menores de 18 años. Según la Organización Mundial de la Salud: “el cáncer en menores de 15 años representa entre un 0,5% y un 4,6% de la carga total de morbilidad por esta causa, con tasas mundiales de incidencia, que oscilan entre 50 y 200 casos por cada millón de niños en las distintas partes del planeta”(2,3).
De acuerdo con la información publicada en Globocan (Global Cancer Observatory) en 2018, los tumores más frecuentes en la edad pediátrica a nivel mundial fueron las leucemias con 78.069 casos nuevos, los tumores del sistema nervioso central con 30.106 casos nuevos, el linfoma no Hodgkin con 22.964 y el linfoma Hodgkin con 13.806. En América Latina y el Caribe 32.386 menores de 18 años fueron diagnosticados con cáncer(4). En Colombia, según el reporte de la situación del cáncer en la población atendida en el Sistema General de Seguridad Social en Salud, liderado por el Fondo Colombiano de Enfermedades de Alto Costo, en 2017 se presentaron 1.754 casos de leucemia linfoide aguda, 477 casos de linfoma no Hodgking, 301 casos de linfoma Hodgking y 190 casos de leucemia mieloide aguda en menores de 18 años(5), cifras que coinciden con los reportes del Registro Poblacional de Cáncer de Cali (RPC)(6), el Instituto Nacional de Cancerología(7) y los datos epidemiológicos reportados por el Ministerio de Salud y Protección Social(8).
El cáncer puede ser clasificado en dos grupos: tumores hemato-linfoides (leucemia y linfoma) y tumores sólidos. Los tumores más frecuentes en la infancia (0-14 años) son las leucemias, seguidas de los tumores del sistema nervioso central y los linfomas (Hodgkin y no Hodgkin). En la adolescencia (15-19 años) son más frecuentes los linfomas, seguidos de los tumores de sistema nervioso central y las leucemias; en este grupo de edad se presenta también mayor incidencia de melanomas malignos, tumores germinales y carcinoma de tiroides, comparado con las personas menores de 15 años(9).
La leucemia se define como una aberrante hiperproliferación de células sanguíneas inmaduras que no forman masas tumorales sólidas, que pueden ser agudas o crónicas(10). La leucemia linfoide aguda (LLA) es una patología inmunofenotípicamente heterogénea, que representa expansiones clonales de linfoblastos en diferentes estadios de maduración, y sustituyen progresivamente a los componentes normales de la médula ósea (MO), invaden la sangre periférica (SP) e infiltran distintos órganos y tejidos, generando la aparición de síntomas y signos clínicos (infecciones frecuentes, fiebre que no desaparece, debilidad y cansancio constante, dolor óseo, inflamación de los ganglios linfáticos (del cuello, las axilas y la ingle), palidez, sangrado o aparición de hematomas con facilidad, dificultad para respirar, dolor de cabeza y hígado o bazo agrandados(11,12).
Para el estudio de las células leucémicas se utilizan técnicas morfológicas, citoquímicas, citogenéticas, de biología molecular e inmunológicas(3), que permiten identificar la línea específica de origen, su nivel de maduración y en algunos casos la clonalidad del proceso. Esto es importante para el entendimiento de las características fenotípicas de las células leucémicas en el diagnóstico de las variedades de la LLA, y la comprensión de las diferentes formas clínicas de expresión de la enfermedad, definir el tratamiento específico y predecir el pronóstico, la evolución y la sobrevida de los enfermos(13).
El pronóstico de la enfermedad depende del tipo del tumor, la extensión de la enfermedad en el momento del diagnóstico y la eficacia del tratamiento. En países desarrollados se estima que aproximadamente entre el 60% y el 80% de los niños con cáncer se curan, mientras que en países menos desarrollados, el 50% de los niños con diagnóstico de cáncer fallece; debido a que se presentan dificultades en el acceso a los servicios de salud, en la oportunidad del diagnóstico e inicio del tratamiento y posiblemente al abandono del mismo por barreras de acceso de tipo económico o geográfico(14,15).
La enfermedad mejora cuando se diagnostica y se empieza a tratar en estadios iniciales, esto permite: usar tratamientos menos intensos, reducir el riesgo de complicaciones relacionadas con la enfermedad y con el tratamiento, disminuir las secuelas orgánicas y psicológicas, los tiempos y costos de hospitalización o servicios tendientes a la atención integral del cáncer y por ende la mortalidad(13).
En la actualidad, el 70% de los niños con leucemia linfoblástica aguda, tienen una tasa de sobrevida superior a 5 años; sin embargo, la situación es diferente para los niños con cáncer de países en desarrollo, donde se estima una sobrevivencia entre 10% y 20% menor que la de aquellos en su misma situación en países desarrollados. Las causas de esta situación se adjudican al diagnóstico tardío, el limitado acceso al tratamiento, su abandono y la recurrencia de la enfermedad(13,14).
A diferencia del cáncer en adultos, no es posible implementar estrategias de prevención primaria para el cáncer en niños y adolescentes, así como tampoco existen métodos de tamización que permitan la detección temprana. El cáncer pediátrico se caracteriza por tener una presentación predominantemente tisular, los casos son detectados generalmente de forma accidental, dado que los signos y síntomas son tan comunes que pueden confundirse con otras enfermedades; sin embargo, los tumores diagnosticados en la infancia tienen mejor pronóstico, responden y toleran mejor el tratamiento y se logra una mayor supervivencia comparados con los tumores en adultos(13).
Dado el interés actual del tema, por su impacto en la salud pública y sus implicaciones en todas las esferas económica política y social, este estudio tiene como objetivo identificar la incidencia de leucemia linfoide aguda (LLA) en los pacientes con cáncer infantil en el departamento de Antioquia en el primer semestre del 2017 y explorar la relación con factores demográficos.
Estudio observacional, descriptivo, transversal, retrospectivo con intención analítica, para la identificación de la incidencia de la leucemia linfoide aguda y su asociación con determinantes demográficos no causales, de pacientes con cáncer infantil del departamento de Antioquia en el 2017.
El proceso de obtención de la información inició con la solicitud formal a la Dirección Seccional de Salud y Protección Social de Antioquia (DSSYPSA) para acceder a los datos de pacientes pediátricos con cáncer en el departamento durante el 2017. Se tomó información de fuente secundaria, a partir del Sistema de Vigilancia en Salud Pública (SIVIGILA) 2017 para el evento de vigilancia en salud pública de cáncer infantil (ficha 115). Se realizó censo de todos los registros y como medida para controlar los sesgos de información, se excluyeron aquellos que tenían datos faltantes por encima del 10%. En total se incluyeron 190 registros para el estudio.
La variable dependiente del estudio fue el cáncer pediátrico, donde la categoría de riesgo fue la LLA y los demás tipos de cánceres fueron la categoría de referencia. Se incluyó la oportunidad en la confirmación del diagnóstico de los pacientes de cáncer infantil, medida como el tiempo que transcurre desde la fecha de resultado de la prueba diagnóstica que sugiere al médico la probabilidad de cáncer y la fecha de resultado de prueba confirmatoria. El diagnóstico probable se evaluó por signos, síntomas y el diagnóstico confirmatorio por biopsia de médula ósea. Estas variables fueron categorizadas como: oportunidad alta (≤ 15 días) y oportunidad baja o tardía (≥ 16 días). Se consideró otras variables demográficas como: sexo, área de residencia (urbano, rural), edad, municipio de residencia, afiliación al sistema general de seguridad social en salud, hospitalización y condición final del niño.
Se realizó un análisis descriptivo de todas las variables, calculando medidas de frecuencia y medidas de resumen en el software SPSS® versión 21 (licencia Universidad CES). La edad, la oportunidad de diagnóstico probable y confirmatorio fueron recategorizadas y se utilizó la prueba Chi-Cuadrado de Independencia (X2) de Pearson, con el fin de establecer asociaciones bivariadas entre el cáncer pediátrico, tomando como categoría de riesgo la LLA y las demás variables, donde se hallaron razones de prevalencia crudas, intervalos de confianza y valores p. Por último, se realizó análisis multivariado por medio de regresión logística binaria múltiple, utilizando el método introducir, donde se incluyeron variables con valores de p<0,25 de acuerdo con el criterio Hosmer y Lemeshow(16) y se calcularon razones de prevalencia ajustadas por las variables independientes, sus intervalos de confianza del 95% y el nivel de significancia estadística, el cual, se fijó con un valor p<0,05.
De acuerdo con la Resolución 8430 de 1993 del Ministerio de Salud por la cual se establecen las normas científicas, técnicas y administrativas para la investigación en salud este estudio se clasificó como “sin riesgo” considerando que se trataba de un estudio con información de fuente secundaria y fue avalado por Comité Institucional de Ética en Investigación en Seres Humanos de la Universidad CES.
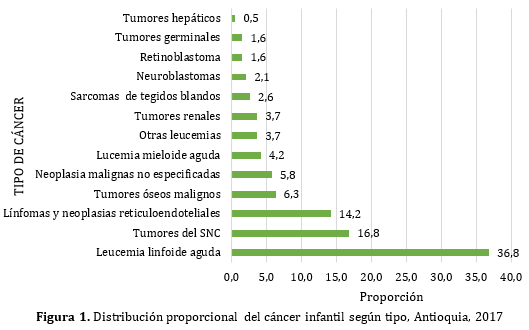
Se analizaron 190 registros de pacientes con cáncer pediátrico, en la figura 1 se presenta la proporción según tipología.
De acuerdo con la distribución de cáncer pediátrico por sexo, en el año 2017, la mayor proporción de casos notificados se presentó en el sexo masculino con el 51,1%. Se observó que el 85,8% eran residentes del área urbana, el 59,2% pertenecían al régimen contributivo en salud, el 77,9% fueron hospitalizados en algún momento y el 12,6% fallecieron. Al aplicar la prueba de normalidad de Kolmogorov – Smirnov, para verificar las variables, edad, oportunidad de diagnóstico probable, el valor de p calculado demostró que no se ajustan a una distribución normal. Se observó que el 50% de los pacientes tuvieron 8 años o menos de edad (RIQ: 9 años), mientras que el 50% de la población pediátrica tuvo diagnóstico confirmatorio con 1 días o menos (RIQ: 6 días) (Tabla 1).
Geográficamente el departamento de Antioquia se encuentra dividido en 9 subregiones, la más poblada es la del Valle de Aburrá, en la que se encuentra la capital y otros 9 municipios aledaños, representando aproximadamente la mitad de la población de Antioquia; le siguen en número de habitantes las subregiones de Urabá y Oriente. Se observó que la tasa de incidencia de cáncer infantil del departamento en el 2017 fue de 10 casos por cada 100.000 habitantes menores de 18 años, mientras que la tasa de LLA fue de 4 por cada 100.000 habitantes menores de 18. Se destaca que las subregiones del Magdalena medio y el Valle de Aburrá presentaron una tasa de incidencia mayor a la del departamento, 12,7 y 12,1, respectivamente. Las subregiones de Bajo Cauca (9,1), Nordeste (7,5), Norte (7,4), Urabá (6,1) y Suroeste (5,6), reportaron tasas de incidencia por debajo de la media departamental que fue 9,9.
Tabla 1. Descripción de los determinantes sociodemográficos de los pacientes con cáncer pediátrico. Antioquia, 2017.
| Variables | n | % |
| Sexo | ||
| Masculino | 97 | 51,1 |
| Femenino | 93 | 48,9 |
| Área de residencia | ||
| Urbana | 163 | 85,8 |
| Rural | 27 | 4,2 |
| Régimen en salud | ||
| Contributivo | 109 | 59,2 |
| Subsidiado | 72 | 39,1 |
| Especial | 1 | 1,6 |
| Hospitalización | ||
| Si | 148 | 77,9 |
| No | 42 | 22,1 |
| Condición final | ||
| Vivo | 166 | 87,4 |
| Muerto | 24 | 12,6 |
| Edad | 8,0* | 9,0+ |
| Oportunidad de diagnóstico probable | 1,0* | 3,0+ |
| Oportunidad de diagnóstico confirmatorio | 1,0* | 6,0+ |

Se observó que la probabilidad de LLA aumenta en un 1% en los hombres, al compararlos con las mujeres (RPc: 1,01 IC95%: 0,56 - 1,84), pero esta asociación no es estadísticamente significativa. La proporción de LLA de los que residían en área rural fue del 18,6% y tuvieron 1,55 veces mayor probabilidad de tener LLA con respecto a los que vivían en zona urbana. Por su parte, la pertenencia al régimen subsidiado incrementa la probabilidad de aparición de este tipo de cáncer pediátrico en un 25%, al comparar con los de régimen contributivo, sin embargo, esta relación no es significativa.
Con relación a la edad del paciente se evidenció que tener 10 años o más aumenta la probabilidad de LLA (RPc: 1,40 IC95%: 0,81 – 2,66). Por su parte, se encontró una asociación significativa (p = 0,020) entre tener un diagnóstico probable entre 16 o más días y la disminución de la probabilidad de aparición de LLA (RPc: 0,30 IC95%: 0,03 – 0,76), al igual que tener un diagnóstico confirmatorio entre 16 o más días, pero esta última asociación no fue significativa (Tabla 2).
Para realizar el análisis multivariado, se incluyó la variable oportunidad en diagnóstico probable, por criterio estadístico de p<0,05, también se ingresaron las variables área de residencia (rural), edad (≥ 9 años) y oportunidad en diagnóstico confirmatorio (≥ 16 días) por criterio de Hosmer y Lemeshow, adicionalmente se incluyó el sexo por criterio del investigador. Al realizar el ajuste de la Razón de Prevalencia (RP) mediante el modelo de regresión logística binaria múltiple, tres variables conservaron la condición de aumentar la probabilidad de LLA: ser hombre, residir en el área rural y pertenecer al régimen subsidiado. Sin embargo, ninguna fue estadísticamente significativa (Tabla 3).
Tabla 2. Determinantes sociodemográficos asociados a la leucemia linfoide aguda en pacientes pediátricos
| Variable | Leucemia linfoide aguda | Razón de Prevalencia (RP) crudo [IC 95%] | Valor p | |||
| Si | No | |||||
| n | % | n | % | |||
| Sexo | ||||||
| Hombre | 36 | 51,4 | 61 | 50,8 | 1,01 [0,56 – 1,84] | 0,937 |
| Mujer | 34 | 48,6 | 59 | 49,2 | 1 | - |
| Área de residencia | ||||||
| Urbana | 57 | 81,4 | 106 | 88,3 | 1 | - |
| Rural | 13 | 18,6 | 14 | 11,7 | 1,55 [0,76 – 3,92] | 0,192 |
| Afiliación | ||||||
| Contributivo | 39 | 56,5 | 73 | 63,5 | 1 | - |
| Subsidiado | 30 | 43,5 | 42 | 36,5 | 1,25 [0,72 – 2,45] | 0,350 |
| Edad | ||||||
| ≤ 8años | 40 | 57,1 | 57 | 47,5 | 1 | - |
| ≥ 9 años | 30 | 42,9 | 63 | 52,3 | 1,40 [0,81 – 2,66] | 0,200 |
| Oportunidad en diagnostico probable | ||||||
| ≤ 15 días | 68 | 97,1 | 92 | 85,2 | 1 | - |
| ≥ 16 días | 2 | 2,9 | 16 | 14,8 | 0,30 [0,03 – 0,76] | 0,020 |
| Oportunidad en diagnostico confirmatorio | ||||||
| ≤ 15 días | 61 | 93,8 | 96 | 88,1 | 1 | - |
| ≥ 16 días | 4 | 6,2 | 13 | 11,9 | 0,56 [0,15 – 1,55] | 0,223 |
Tabla 3. Determinantes sociodemográficos que explican la leucemia linfoide aguda, pacientes con cáncer pediátrico
| Variable | RP crudo [IC 95%] | Valor p | RP ajustado [IC95%] | Valor p |
| Sexo (hombre) | 1,01 [0,56 – 1,84] | 0,937 | 1,02 [0,52 - 2,02] | 0,938 |
| Área de residencia (rural) | 1,55 [0,76 – 3,92] | 0,192 | 1,59 [0,55 – 4,56] | 0,385 |
| Afiliación en salud (subsidiado) | 1,25 [0,72 – 2,45] | 0,350 | 1,41 [0,68- 2,92] | 0,347 |
| Edad (≥ 9 años) | 1,40 [0,81 – 2,66] | 0,200 | 0,76 [0,38 – 1,50] | 0,440 |
| Oportunidad en el diagnóstico probable (≥ 16 días) | 0,30 [0,03 – 0,76] | 0,020 | NC* | NC |
| Oportunidad en el diagnóstico confirmatorio (≥ 16 días) | 0,56 [0,15 – 1,55] | 0,223 | 0,34 [0,10 – 1,15] | 0,085 |
| *No-calculado |
De acuerdo con cifras publicadas por la OMS en el 2016, el cáncer en menores de 15 años representa el 4,6% de la carga total de la morbilidad por esta causa, con tasas generales de incidencia que oscilan entre 50 a 200 casos por cada millón de niños y 90 a 300 por cada millón de adolescentes(2), superiores al reporte encontrado en el departamento de Antioquia para menores de 18 años, con una tasa de incidencia de cáncer infantil de 10 casos por cada 100.000 y de LLA de 4 casos por cada 100.000 habitantes. Actualmente, la proporción de cáncer en niños es del 84% en los países con Índice Desarrollo Humano (IDH) bajo, al compararlos con los países IDH alto(17).
En Colombia para el 2016, según cifras del Departamento Administrativo Nacional de Estadística (DANE), se presentaron 838 muertes por cáncer por leucemia, tumores del sistema nervioso central, ojo, tumores óseos, articulares y linfomas(5). De acuerdo a las cifras reportadas en el informe de situación de cáncer en la población adulta atendida en el Sistema General de Seguridad Social en Salud de Colombia de la cuenta de alto costo en el 2017, se presentaron 1754 casos nuevos de LLA, de los cuales 70 se reportaron en Antioquia(7). En países de altos ingresos se obtienen mejores resultados de supervivencia, gracias a la mejor oportunidad en el acceso a los avances tecnológicos y de medicamentos, con una tasa de 80%, mientras que en países de bajos ingresos oscila entre 5% y 60%(18,19).
En cuanto a los determinantes demográficos asociados a la leucemia linfoide aguda, no se identificó diferencias significativas en relación al sexo con los diferentes tipos de cáncer, a pesar del ligero predominio masculino; estos datos concuerdan con los publicados por Ezzat et al.(20), pero difiere con lo publicado con Steliarova-Foucher et al.(21), quienes realizaron un estudio de registro poblacional, ideado por la Agencia Internacional para la Investigación del Cáncer en colaboración con la Asociación Internacional de Registros de Cáncer, donde recopilaron datos sobre todas las neoplasias malignas y neoplasias no malignas del SNC diagnosticadas antes de los 20 años en poblaciones cubiertas por registros de cáncer de calidad con datos completos para 2001 a 2010.
En este estudio la residencia rural aumentó la probabilidad de LLA, resultados similares a los reportados por Bona et al.(22), que demostraron que los niños estadounidenses con LLA que viven en áreas de alta pobreza y ruralidad tienen un mayor riesgo de recaída temprana en comparación con aquellos que viven en áreas de baja pobreza a pesar del tratamiento uniforme. Al igual que Gupta et al.(23), hallaron que la distancia desde el centro terciario o la residencia rural predijeron significativamente la supervivencia libre de LLA. Pero contrarios a los hallazgos de Erdmann et al.(24) que encontraron que los determinantes socioeconómicos (entre ellos la ruralidad) no afectaron la supervivencia de los niños con LLA de Alemania Occidental.
Al igual que los estudios de Terwilliger y Abdul-Hay(25), Rytting et al.(26) y Schraw et al.(27), la edad inferior a 9 años se comporta como un factor que se asocia al desarrollo de LLA. Los niños que fueron diagnosticados después de 16 días presentaron una mayor probabilidad de aumentar la progresión de la enfermedad y consecuentemente el riesgo de muerte, este resultado es similar a lo reportado por Vizcaíno et al., quienes concluyen que la demora en la remisión a un especialista ante la sospecha de cáncer y la iniciación tardía o suspensión del tratamiento, pueden significar la diferencia entre la vida y la muerte(28). Así, la oportunidad diagnóstica probable o confirmatoria, es un importante predictor de la LLA(29).
Se debe leer con especial cuidado los resultados, pues el diseño transversal del estudio limita la inferencia causal, por ello, estos son aplicables sólo a la población en la cual se realizó el estudio. El hecho de tener información secundaria no permitió trabajar con otros confusores importantes para comprender los factores no etiológicos de la LLA y sólo se logró trabajar con determinantes demográficos. La principal fortaleza del estudio fue la selección completa de los casos, pues, se trabajó con el censo total de los registros de pacientes pediátricos del departamento en el 2017, situación que controla en mayor medida los sesgos de selección en el estudio.
Los resultados de este estudio refirman la necesidad de generar acciones e intervenciones desde la promoción de la salud y prevención de la enfermedad, enfocadas a controles variables asociadas al riesgo de LLA. Se requiere la participación de la ciudadana en la formulación de políticas públicas, fomento de redes de apoyo comunitario, participación en programas de educación.
Factores demográficos como ser hombre, residir en zona rural, pertenecer a un régimen en salud que limita el acceso a la prestación de los servicios de salud y un diagnóstico tardío, se han asociado con la presencia de LLA en niños con cáncer.