Introducción
El virus de la hepatitis E (HVE), es un virus de ARN (Ácido Ribonucleico) desnudo que pertenece a la Familia Hepeviridae, género Orthohepevirus con cuatro especies (A-D) y Piscihepevirus con una especie. El género Orthohepevirus A incluye a todas las variantes que infectas mamíferos; dividido en 8 genotipos, de los cuales por lo menos 4 de estos, son de interés para la salud pública humana1,2. Los genotipos 1 y 2 (HVE1 y HVE2) infectan únicamente humanos y son responsables de casos esporádicos transmitidos por el agua. Los genotipos 3 y 4 (HVE3 y HVE4) son capaces de generar infección en animales y humanos, siendo el cerdo es el principal reservorio y trasmisor zoonótico de la infección1,2.
El HVE es transmitido principalmente por vía fecal oral, consumo de agua contaminada con heces humanas o de cerdo, carne de cerdo mal cocida y transfusiones de sangre o sus derivados1,2. Se han reportado dos patrones epidemiológicos en el mundo: híper-endémicos e hipo-endémicos, los cuales difieren en los patrones de infección, la prevalencia del virus y genotipos infectantes; por ejemplo, el genotipo 1 se presenta en el sudeste de Asia, Asia central y norte del África, por su parte, el genotipo 2 se ha reportado en México y África occidental, el genotipo 3 se ha identificado en América, Europa y Japón y el genotipo 4 en China y sudeste asiático3. En Colombia se han reportado la presencia de genotipo 3 y anticuerpos en donantes de sangre, en trabajadores de granjas porcicolas y en personas con diagnóstico de hepatitis, con prevalencias que oscilan entre 7,5 a 45,3% dependiendo del estudio4-7.
Las muestras de suero en fase de viremia son utilizadas para el diagnóstico molecular, para ello se amplifica la región ORF3/ORF2 del marco abierto lectura ORF (Open Reading Frame) del genoma, la detección de anticuerpos IgM en suero, se utiliza para identificar una infección aguda y la detección de anticuerpos IgG evidencia un contacto previo con el virus o una infección aguda si se encuentran en conjunto con la IgM. El periodo de incubación va entre 2 a 8 semanas, el ARN viral puede ser detectado en sangre hasta 3 semanas después de inicio de síntomas y perdura 3 semanas más en heces. La IgM se detecta en sangre a partir del primer mes de la infección coincidiendo con el inicio de síntomas y perdura aproximadamente durante 32 meses8-11.
El departamento del Quindío, es una región principalmente agrícola donde se cuenta con un alto número de granjas porcinas con y sin certificación, por lo tanto está presente la posibilidad de la contaminación del agua o alimentos, generando un posible ciclo de infección por este virus12,13. Previamente se ha reportado la presencia de anticuerpos IgG e IgM en donantes de sangre y en sueros de pacientes con Hepatitis4,5, pero no se ha encontrado en la bibliografía consultada reportes de estudios que identifiquen anticuerpos en personas de la comunidad en el eje cafetero, por lo tanto este trabajo tuvo como objetivo determinar la prevalencia de anticuerpos anti-HVE de tipo Inmuniglobulinas G (IgG) en muestras de suero de un laboratorio clínico del Eje Cafetero.
Materiales y métodos
Tipo de estudio
Se realizó un Estudio descriptivo retrospectivo de corte transversal en sueros que reposaban en la seroteca del Laboratorio Clínico del Centro de Investigaciones Biomédicas (CIBM) de la Universidad del Quindío, de personas que acudieron al servicio de laboratorio y que previamente habían firmado consentimiento para el uso de estos sueros en investigación. Como periodo de evaluación se consideró los meses de agosto y septiembre de 2018.
Criterios de inclusión y exclusión
Se utilizaron todos los sueros obtenidos en los meses de estudio en el laboratorio clínico del CIBM de la ciudad de Armenia. Con el fin de eliminar posibles sesgos por infecciones agudas en el hígado, incluido Hepatitis víricas, se excluyeron del estudio los sueros a los que se había realizado pruebas de función hepática, teniendo en cuenta que se estaba analizando prevalencia de anticuerpos IgG.
Muestreo
La muestra fue tomada a conveniencia, teniendo en cuenta que se realizó un estudio con tres pruebas comerciales diferentes. Teniendo en cuenta que esta investigación se realizó con muestras previamente tomadas, los únicos datos con los que se contaban de los pacientes eran: dirección de residencia, edad y el sexo. No fue posible obtener otros datos relevantes para el estudio.
Evaluación de la presencia de HVE IgG
Se utilizaron tres técnicas para la identificación de los anticuerpos: ELISA IgG anti HVE Recom Well marca Mikrogen, ELISA para anticuerpos totales HVE Ab versión ULTRA® marca Diapro y prueba de western blot, Recom-line HVE marca Mikrogen. Todas las pruebas se realizaron siguiendo las recomendaciones del fabricante. Adicionalmente a las pruebas positivas para anticuerpos IgG se realizó la identificación de IgM por la técnica Recom-line HVE marca Mikrogen.
Análisis estadístico
Se realizó una estadística descriptiva, para identificar los porcentajes de positividad de las diferentes pruebas comerciales, al igual que en la comparación de los resultados obtenidos en las tres pruebas utilizadas en este estudio. No se realizó Análisis estadísticos teniendo en cuenta que el objetivo del proyecto fue evidenciar la prevalencia de anticuerpos IgG en población general que acudía a un laboratorio clínico de la ciudad de Armenia.
Consideraciones éticas
Esta investigación considera Sin Riesgo según la resolución 8430 de 1993 del Ministerio de salud de Colombia. Adicionalmente, se contó con el aval de la seroteca del Laboratorio Clínico CIBM de la Universidad del Quindío para trabajar con las muestras de pacientes que habían firmado previamente consentimiento informado para usar el material con fines de investigación.
Resultados
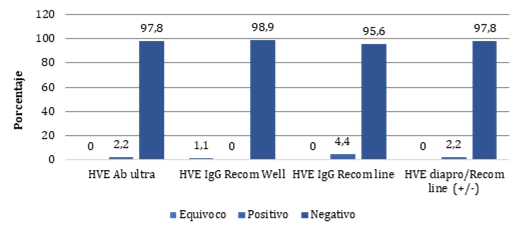
Se identificaron 2 sueros positivos para anticuerpos totales anti HVE mediante la técnica de ELISA de anticuerpos totales marca Diapro (2,2%), la Prueba ELISA IgG HVE Recom well marca Mikrogen no identificó ninguna muestra positiva, pero evidenció una muestra equivoca (1,1%), finalmente se detectó 4 muestras positivas con la prueba Recom-line IgG HVE (4,4%) (Figura 1).
Figura 1. Porcentaje de resultados obtenidos por diferentes técnicas de diagnostica para IgG HVE.
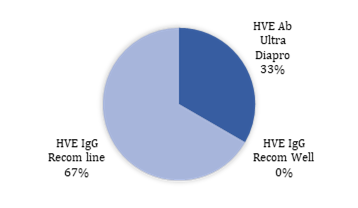
Del porcentaje total de pruebas positivas la prueba Recom-line IgG HVE representó el 67% de positividad, y la prueba HVE Ab el 33% de positividad (Figura 2).
Figura 2. Porcentaje de positividad de anticuerpos IgG HVE obtenido por diferentes marcas comerciales.
Se presentó una proporción igual en ambos sexos de resultados positivos para IgG HVE. No se presentó ninguna muestra positiva en pacientes menores de 20 años (datos no mostrados), hubo dos muestras positivas para el grupo etario entre 21 y 30 años que correspondientes a un hombre y una mujer; se presentó una muestra positiva en el género femenino en el grupo etario de 31 y 40 años, y en mayores de 50 años se presentó una muestra positiva en un hombre. (Tabla 1). La prueba que detectó mayor número de personas positivas para IgG HVE fue Recom line Mikrogen (4 pacientes), seguida por la prueba HVE Ab ultra Diaporo con 2 muestras positivas, por último, la prueba Recom well marca Mikrogen no presentó resultados positivos.
Tabla 1. Descripción de muestras para la identificación de anticuerpos IgG/IgM HVE
Discusión
El departamento del Quindío, es un departamento principalmente agrícola. En la página del Instituto colombiano agropecuario en el censo porcino de 2018, se encuentran reportadas 302 granjas porcinas tecnificadas y 1430 sin tecnificar, con un total de cerdos de 70158 animales, los municipios con mayor concentración de cerdos son Circacia, Filandia, Calarcá, Quimbaya y Armenia12,13.
Teniendo en cuenta la alta cantidad de porcinos que existe en el departamento del Quindío y que por escorrentía de las aguas lluvias parte de estos desechos pueden terminar en los afluentes14. Es probable que personas hayan estado en contacto con el virus, por lo tanto, de los 90 sueros analizados y de acuerdo con la técnica utilizada, se encontraron 4 muestras positivas; pero no fue posible determinar a través de los datos que poseía el laboratorio, hace cuánto tiempo las personas residían en el Quindío, si habían estado en contacto previo con cerdos o si habían presentado hepatitis.
Se encontró una prevalencia para anticuerpos IgG que oscilan entre 0 a 4,4% de acuerdo con la técnica utilizada, este porcentaje es relativamente bajo comparado con los trabajos realizados por Peláez et al. en 2014, quienes reportaron un porcentaje HVE IgG del 7,5% y para IgM del 1,74% en sueros remitidos al Instituto Nacional de Salud (INS) de diferentes departamentos de Colombia6. De igual manera, esta misma autora, reporta en el 2016 un porcentaje para HVE IgG de 25,3% y 33,6% de co-infección HVA/HVE5, por su parte Duque et al., en el año 2016, reportaron una positividad para anticuerpos IgG de HVE del 45,2% en sueros de donantes de sangre de Yarumal Antioquia4 y Betancur et al.7, en el 2013 evaluaron la presencia de IgG HVE en 98 personas que laboraban en granjas porcinas en el departamento de Antioquia, encontrando un 11,5% de anticuerpo HVE IgG en esta población.
Este menor porcentaje de positividad para los anticuerpos HVE IgG, puede estar relacionado con el hecho de que en los trabajos de Peláez se utilizaron sueros que fueron remitidos al INS asociados a vigilancia epidemiológica de pacientes en el país y en uno de los trabajos se analizaron sueros con ictericia lo cual selecciona un tipo específico de muestra. Respecto al trabajo de Betancur et al.7 el mayor porcentaje encontrado puede explicarse porque la población objeto de estudio está directamente en contacto con el principal reservorio de Hepatitis E que es el cerdo, por lo tanto, la posibilidad de infección es mayor y consecuentemente la presencia de anticuerpos. Duque et al.4, afirman que el 45,2% de HVE IgG encontrado en los donantes de banco de sangre, estaría explicado probablemente por un contacto con cerdos infectados o exposición a agua contaminada, esta hipótesis puede ser válida teniendo en cuenta que Yamural es doceavo municipio con mayor número de porcinos en el departamento de Antioquia de sus 125 municipios13.
Otro aspecto importante a resaltar en este trabajo, es el hecho de la variabilidad de los resultados de acuerdo con las pruebas utilizadas, para el caso particular de este estudio se observó un resultado equivoco en una de las pruebas de ELISA, 2 pruebas positivas para anticuerpos totales por ELISA, que coincidieron con el resultado positivo por western blot; y dos muestras más, positivas, por esta técnica que fueron negativas por ELISA. (Tabla 1 y Figura 2), esta variabilidad puede explicarse por el tipo de antígeno utilizado y el tipo de prueba a realizar, en las dos pruebas de ELISA (HVE Ab ultra Diapro; Recom Well Mikrogen), se utilizan antígeno recombinante purificado de virus de HVE, en la prueba HVE Ab ultra Diapro no se puede determinar el tipo de proteína utilizada ni los genotipos que identifica, la única información que se encuentra en el inserto del kit, se relaciona con proteínas recombinantes derivadas de virus aislados en México y de Birmania15. Respecto a la prueba ELISA Recom well Mikrogen, se especifica que se utilizan proteínas recombinantes purificadas de la región ORF2/3 de los genotipos 1 y 3, llama la atención que antígenos similares se encuentran en la prueba Recom line de esta misma casa comercial, la cual dio 4 muestras positivas para HVE IgG, asociadas a anticuerpos que reconocen los antígenos recombinantes de la región terminal del ORF2 de los genotipos 1 y 316 (Figura 3), mientras que el ELISA presentó un único resultado equivoco. Un trabajo realizado por Wenzel et al.17 en el 2013, reportaron una gran variabilidad en los resultados obtenidos en las pruebas que identifican anticuerpos HVE IgG, la capacidad de la prueba de identificar verdaderos positivos, oscila de acuerdo con la prueba, entre el 83 al 100%; pero la capacidad de identificar los verdaderos negativos es más baja, ya que reportan porcentajes de falsos positivos en las pruebas del 4,5 hasta el 29%. Wu et al., en el 201418, reportaron un rango de sensibilidad entre 66,7-93,3% y especificidad de 62,9-95,6%, de acuerdo con la prueba evaluada; señalan que el uso combinado de las pruebas puede aumentar los valores de sensibilidad y especificidad para la identificación de anticuerpos.
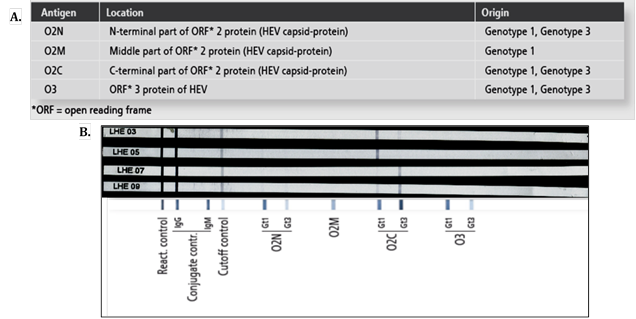
Al-absi et al., en el 201819 reportan una seroprevalencia para anticuerpos HVE IgG que oscila entre 10,1 y 18% de acuerdo con la prueba utilizada, además encuentran una sensibilidad y especificidad para IgG entre 96,5 y 100% en todas las pruebas analizadas, excepto Euroimmun ELISA que presentó sensibilidad de 61,5%. En la revisión sobre diagnóstico de HVE de Al-Sadeq et al.20 en 2018, reportan que la sensibilidad para pruebas diagnósticas que identifican anticuerpos IgM oscila entre el 24 al 97% y la especificidad entre 84 al 100%; la sensibilidad para IgG fue entre 42% y 99,5% y especificidad entre 62,9% y 99,6%. Es importante resaltar que la variabilidad de los resultados obtenidos de acuerdo con los kits comerciales, afectan los resultados de estudios epidemiológicos y probablemente afectan el diagnostico de los pacientes; por lo tanto, es necesario seguir realizando este tipo de trabajos con el fin de evidenciar estas diferencias en las pruebas y poder tomar decisiones en la elección del estuche comercial a utilizar.
Conclusiones
Se identificó una prevalencia de anticuerpos en sueros de pacientes que viven en un área de eje cafetero que oscila entre 0 y 4,4% de acuerdo con la prueba comercial utilizada, lo que demuestra una circulación del virus y un posible ciclo infecciosos en la región.
Existe una variabilidad en los resultados de los estuches comerciales para identificar anticuerpos IgG. La prueba Recom Line Mikrogen IgG fue la que presentó mayor positividad para este tipo de anticuerpos.
Limitaciones del estudio
Este trabajo tuvo como principal limitación el hecho de no poder determinar la procedencia exacta de las personas, si había un contacto previo con cerdos o si habían presentado casos de hepatitis, esta limitación sucede debido a que se tomaron muestras que ya reposaban en una seroteca del laboratorio clínico y no era posible contactar las personas para realizar encuestas sobre estos datos.