Se presentó el caso clínico de una AM centenaria paciente frágil con
COVID-19 (diagnosticada con prueba RT-PCR para SARS-CoV-2), con
multimorbilidad, en contexto de brote de COVID-19 a nivel de la
institución geriátrica en la cual residía, con NEWS y CALL
score muy
elevados, con criterios de severidad, alto riesgo de progresión, pobre
pronóstico (Tabla 1 y Figura 1),
riesgo de mortalidad elevado, con necesidad de oxígeno suplementario a
altas concentraciones. Se diagnosticó y se inició manejo de manera
precoz con desenlace clínico y paraclínico favorable.
Se ha informado que la edad es un predictor de mal pronóstico en
pacientes con COVID-191-4;
además se conoce
que hasta un 27% de los
pacientes mayores de 65 años llegan al servicio de urgencias con
enfermedad grave7, como es
el caso de la
paciente que desde su ingreso
mostraba criterios de severidad de la enfermedad. En estudios recientes
se ha determinado que la desaturación (SaO2<90%),
taquicardia (>100
LPM), taquipnea y alteración del estado de conciencia se comportan
como factores independientes de riesgo de mortalidad en pacientes
AM, así como el antecedente de hipertensión arterial16,
condiciones con las cuales contaba la paciente del caso.
Dentro de los paraclínicos solicitados a la paciente al ingreso, se
identificó linfopenia severa y elevación marcada de PCR, ferritina,
dímero D y LDH. En el estudio de Hewitt et al.,16 estos factores de
igual manera se comportaron como predictores de mortalidad en pacientes
AM. Un criterio adicional al pronóstico ominoso de la paciente fue la
presencia de fragilidad evaluada, en este caso mediante la escala
clínica de fragilidad, siendo una medida subrogada de la edad biológica;
en efecto estudios previos han documentado la relación entre fragilidad
y mortalidad en los pacientes con COVID-19, incluso después de evaluar
la edad cronológica y otras condiciones crónicas de salud presentes16.
Los pacientes AM con multimorbilidad tienen más probabilidad de progresar
a enfermedad grave10. El
envejecimiento se
acompaña de procesos
fisiológicos como la inmunosenescencia, que dificulta el reconocimiento
y eliminación de patógenos y por otro lado hay una exagerada respuesta
inflamatoria sistémica pero ineficaz para eliminar el microorganismo en
cuestión, lo que se traduce en una mayor gravedad de la enfermedad
infecciosa10,13.
Ante signos de severidad de la enfermedad del caso clínico y teniendo en
cuenta la susceptibilidad inmunológica conferida a su edad, se decidió
iniciar manejo médico de carácter temprano (a su ingreso). Con respecto
al manejo clínico de COVID-19 éste debe ser guiado por la Organización
Mundial de la Salud (OMS) y los Centros para el Control y la Prevención
de Enfermedades17 y no
existe una
recomendación específica para los
AM18. Para los casos
graves, el tratamiento
debe incluir cuidados para
apoyar las funciones de los órganos vitales17.
Estas medidas deben
adaptarse a la multimorbilidad, polifarmacia y la fragilidad de los
AM17,19.
Dado que estos
pacientes experimentan
un mayor número y
gravedad de enfermedades crónicas y discapacidades, así como la
disfunción inmunológica20,
en consecuencia el
COVID-19 afectará de
manera desproporcionada a esta población.
Un brote de COVID‐19 en un hogar geriátrico en el área de Seattle,
Washington, se asoció con mortalidad aproximada del 35% de AM y los
informes más recientes destacan la infección en muchos otros centros de
atención geriátricos21,
subrayando el riesgo
de COVID‐19 en esta
población susceptible. La paciente del caso clínico es producto de un
brote de la enfermedad en una residencia geriátrica, lo que activó la
alarma por los antecedentes de alta mortalidad en esta población en
estudios anteriores22.
La multimorbilidad, definida como la coocurrencia de dos o más
condiciones crónicas23, y
la polifarmacia, el
uso de cinco o más
medicamentos, son altamente prevalentes en AM24. Lograr un uso óptimo
de la medicación en esta población es complejo y desafiante en
circunstancias normales. Dado el efecto devastador de COVID-19 en los
AM, particularmente aquellos con multimorbilidad, este desafío sólo
aumenta. Si bien no existe un tratamiento antiviral específico para
COVID-19, la OMS ha priorizado algunos medicamentos para ser
investigados en ensayos clínicos basados en la efectividad clínica
in vitro y los datos de seguridad disponibles19.
Se decidió de manera
interdisciplinar en la UGA administrar desde su ingreso ivermectina,
nitazoxanida, dexametasona, atorvastatina, terapia respiratoria, física
y ocupacional.
Un panel de discusión crítico llegó a la conclusión que la ivermectina
puede ser una molécula potencial para la profilaxis y el tratamiento de
personas infectadas por coronavirus, debido a sus propiedades
antivirales (inhibiendo selectivamente la proteína transportadora de
importina α/β del huésped), lo que disminuye la translocación de la
proteína de la nucleocápside del virus SARS-CoV-2) junto con su bajo
costo, disponibilidad, tolerabilidad y seguridad25. Este fármaco tiene
potencial para convertir la RT-PCR negativa con rapidez, especialmente
en la fase virémica temprana26, razón por la
cual se decidió
utilizarlo una vez diagnosticada la enfermedad en el contexto del brote
en la institución geriátrica. Esta puede considerarse como una opción
terapéutica segura para casos leves, moderados o graves de COVID-1925,
no siendo ajenos a la necesidad urgente de un ensayo clínico aleatorio
con adecuado diseño para el tratamiento de COVID-19.
Los estudios clínicos de ivermectina no incluyeron un número suficiente
de sujetos de 65 años o más para determinar si responden de manera
diferente a los sujetos más jóvenes. Otra experiencia clínica informada
no ha identificado diferencias en las respuestas entre los pacientes AM
y los más jóvenes27. La
paciente recibió una
dosis de 200 mcg/Kg al
ingreso, a los 8 y a los 15 días.
Otra medicación importante utilizada en la paciente, fue la dexametasona
que según el estudio RECOVERY resultó con una menor mortalidad a los 28
días entre los que estaban recibiendo ventilación mecánica invasiva o
necesidad de oxígeno suplementario, con una aceptable participación de
pacientes AM (con más de 40% mayores de 70 años)28. En un metaanálisis
prospectivo de ensayos clínicos de pacientes críticamente enfermos con
COVID-19, la administración de corticosteroides sistémicos, en
comparación con la atención habitual o placebo, se asoció con una menor
mortalidad por todas las causas a los 28 días29. La paciente desde su
ingreso se encontraba desaturada y con necesidad de oxígeno en altas
concentraciones por lo cual se decidió incluir la dexametasona dentro
del tratamiento.
En cuanto a la nitazoxanida recientemente, estudios de laboratorio han
sugerido su papel como agente antivírico de amplio espectro, que
interfiere con la morfogénesis viral en el rotavirus30. También puede
limitar la entrada de virus, la liberación viral y la transmisión de
célula a célula. Asimismo, interferir con las vías reguladas por el
huésped y puede inhibir/suprimir la producción de citocinas
proinflamatorias, incluidas Interleucina 6 (IL-6) y Factor de necrosis
tumoral alfa (TNF α)31,32.
Se ha demostrado
que la nitazoxanida inhibe
el SARS-CoV-2 en estudios in vitro33. No hay
evidencia clara que pueda
ser útil en el entorno clínico. En general, se tolera bien y los efectos
secundarios son escasos34.
Con respecto a las estatinas, éstas son inhibidoras de la proteína de
respuesta primaria de diferenciación mieloide (MYD) 88 impidiendo
inflamación abrumadora en el contexto de la enfermedad35, además
regulan el alza experimentalmente de la expresión del receptor ACE2
protegiendo contra la lesión pulmonar inducida por coronavirus36 y
disminución de la producción de interleucina 18 proinflamatoria
(IL-18)37. Un metaanálisis
determinó un riesgo
significativamente
reducido de enfermedad mortal o grave con el uso de estatinas (HR
agrupado = 0,70; IC del 95%: 0,53 - 0,94) en comparación con el no uso
de estatinas en pacientes con COVID-1935.
Queda mucho por determinar
sobre el régimen de estatinas para el tratamiento de COVID-19, aunque la
evidencia disponible sugiere que la terapia con estatinas de intensidad
moderada a alta podría ser efectiva35. Se
necesitan ensayos
controlados aleatorios bien diseñados en el futuro para confirmar los
beneficios de las estatinas en pacientes con COVID-19.
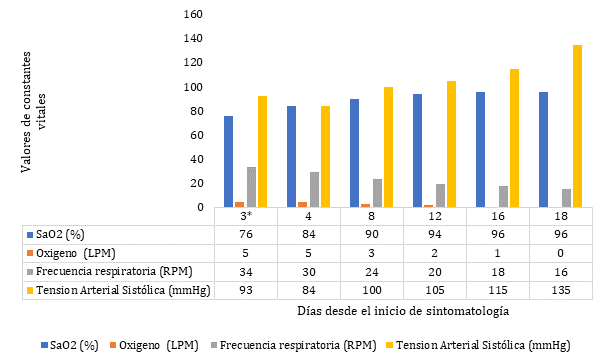
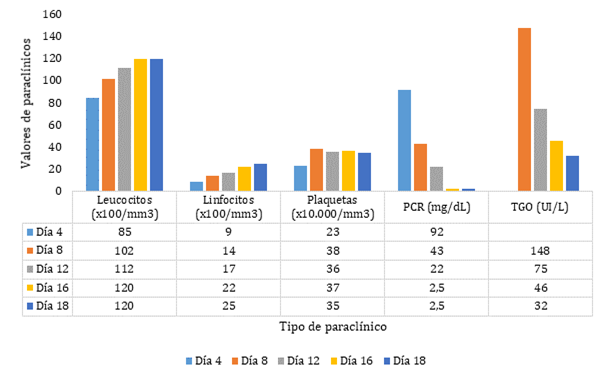
En las gráficas 1 y 2 se muestra la evolución de constantes vitales y de
paraclínicos durante la hospitalización desde su ingreso, tras el pobre
pronóstico y gran riesgo de progresión de la enfermedad al ingreso de la
paciente, se le realizó valoración geriátrica integral y manejo con
equipo interdisciplinario a nivel de una UGA, con instauración del
manejo médico temprano, indicando mejoría de la cada una de las
constantes vitales principales a través de los días de su
hospitalización, como fueron las cifras tensionales, frecuencia
respiratoria, saturación de oxígeno, disminución de reactantes de fase
aguda con aumento progresivo de recuento de linfocitos, lo que podría
indicar el potencial antinflamatorio del manejo, la reducción de
progresión de enfermedad en una paciente con CALL score de 13
puntos y
más que todo la generación de anticuerpos de tipo IgG e IgM teniendo en
cuenta la dificultad para desarrollarlos en AM10,12. Se resalta la
importancia del manejo de la paciente a nivel de la UGA por un equipo
interdisciplinario y una valoración geriátrica integral.
La correlación entre la seropositividad de anticuerpos y la protección
contra la reinfección, así como en los desenlaces y evolución de la
enfermedad y la presencia de comorbilidades en la población geriátrica,
queda aún por dilucidar38.
Se podría atribuir
que la paciente
desarrolló anticuerpos debido a la severidad de la infección desde su
ingreso, o a que el efecto antinflamatorio de las medicaciones
administradas de manera temprana permitió que su sistema inmune se
prepare de una manera adecuada para combatir la infección. Hoy en día es
un caso recuperado de una centenaria con multimorbilidad y fragilidad,
con enfermedad por la COVID-19 categorizada con criterios de severidad,
quien desarrolló inmunidad frente a la infección.
La limitación más importante de este estudio, es que no es posible
generalizar los resultados del manejo instaurado por su naturaleza de
reporte de caso, sin embargo, hace parte de una base para construcción
de hipótesis y posteriores ensayos clínicos aleatorizados que en un
futuro permitan esclarecer su beneficio en términos de eficacia. De
igual forma, serviría como base para casos clínicos similares en una
entidad donde la evidencia y la literatura son escasas y poco
concluyentes.