Introducción
En Colombia y el mundo el pollo se ha posicionado como la principal carne de consumo, lo que estimula a mejorar sus procesos de producción. Sin embargo, la búsqueda de líneas genéticas con crecimiento acelerado por parte de la industria, junto con el manejo de altas densidades animales, trae como consecuencia un aumento de problemas sanitarios, como trazas de antibióticos y detritus metabólicos que llegan al consumidor, contaminación ambiental por residuos del proceso de producción, y aparición de patologías de diferente índole en las aves, como consecuencia del desbalance de la microbiota normal intestinal1. Ante estos problemas las empresas avícolas utilizan alimentos balanceados que en su composición contienen antibióticos promotores de crecimiento (APC)2, sin embargo, las dosis administradas de APC son sub-terapéuticas, lo que a mediano plazo presentan dificultades para mantener el estatus sanitario de las producciones pecuarias3.
Entre los problemas del uso de los APC se encuentra la alteración de la microbiota normal y con ello el metabolismo intestinal de las aves, además de la selección positiva de bacterias resistentes a este tipo de moléculas4,5. Esto último se ha convertido en un problema de salud pública, dado que la producción de pollo es el primer eslabón de la cadena productiva, derivando en la transmisión de microorganismos y trazas de antibióticos, como también detritus metabólicos que afectan la salud humana del consumidor final6.
El aumento de resistencia microbiana llevó a los gobiernos a la creación de leyes que regulan y, en muchos casos, prohíben los APC en la alimentación de aves para consumo humano, lo que se convierte en un reto para los actuales sistemas de producción que intentan encontrar un sustituto viable a este tipo de productos7.
En la actualidad las investigaciones en sanidad pública se encaminan a la búsqueda de microorganismos benéficos (probióticos) como aditivos que reemplacen los APC. Algunos estudios demuestran efectos positivos de las bacterias ácido lácticas y su potencial como agentes moduladores de la microbiota normal del tracto digestivo y su consiguiente salud intestinal, lo que indica que pueden convertirse en una alternativa a los APC y aportar en la solución de problemas prioritarios de salud pública derivados de la ingesta de pollo considerada como la principal carne de consumo humano8.
Por lo anterior, la presente investigación buscó determinar el efecto de L. plantarum microencapsulado sobre parámetros intestinales e inmunológicos en pollos de engorde.
Materiales y métodos
Localización
La investigación se realizó en las instalaciones de la Clínica Veterinaria Carlos Martínez Hoyos y el laboratorio de investigación PROBIOTEC-FORAPIS de la Universidad de Nariño. Las instalaciones contaron con calefacción para las aves y el manejo de la humedad ambiental, ajustados según los manuales de procedimientos disponibles en el bioterio que garantizaron la reproducibilidad de los resultados.
Activación y obtención de inóculo
Se utilizó la cepa de reference L. plantarum ATCC® 8014, reconstituida de acuerdo al inserto de la casa comercial. Para la obtención del inóculo se siguieron los protocolos publicados por Jurado et al.9, donde la cepa fue sembrada en medio De Man, Rogosa y Sharpe, (MRS Oxoid® USA) por un periodo de 24 h, a una temperatura de 37°C, con una densidad del inóculo de 1,3 x 1013 UFC/mL, obtenida a las 12 h de incubación, al final de la fase exponencial. Luego de obtener la fase exponencial de crecimiento de L. plantarum, se tomó una muestra mediante asa y con ella se inoculó 40 mL de caldo MRS comercial De Man, Rogosa y Sharpe, (Oxoid® USA) estéril. Se incubó por 24 h a 37°C en incubadora (Shel Lab ® SMI7-Doral, FL 33152-USA). Se tomaron 4 mL del medio incubado para depositarlos en otros 40 mL de caldo MRS, este se llevó a las mismas condiciones de incubación, calculando al final la densidad celular, en número de bacterias por mL. Cuando se presentó mayor población de la establecida según el Estándar de Mc Farland 2, se adicionó caldo MRS estéril, teniendo en cuenta el cálculo matemático de proporcionalidad descrito por Montes et al.10.
Obtención del microencapsulado
La microencapsulación se realizó según la metodología descrita por Rodríguez et al11. Se prepararon 400 mL de inóculo al 15% p/v de L. plantarum (60 g de Maltodextrina y 60 g de Inulina en 280 mL de inóculo a 1,3 x 1013 UFC/mL) en relación 1:1 p/p, esta mezcla fue homogenizada y se llevó a equipo de aspersión (Secador Spray Bilon 6.000s, Alemania®) por 2 h y 30 min a una temperatura de 170°C a la entrada y 67°C a la salida. El microencapsulado se almacenó a temperatura ambiente del laboratorio (20°C) en recipientes de plásticos oscuros, previamente esterilizados.
Evaluación de la viabilidad y eficiencia del microencapsulado
La viabilidad se determinó a los 22 días de la elaboración del microencapsulado. Para este proceso se tomó 1 g de muestra y se depositó en 9 mL de agua peptonada tamponada al 0,1% p/v, a (20°C) y un pH de 7,2±2; se homogenizó y se dejó reposar por 30 min a 20°C. Seguidamente se tomaron 100 µL de la mezcla, que fueron sembrados en cajas de petri que contenían agar MRS-Azul de anilina al 0,1%, mediante la técnica de siembra en superficie. Se incubó en aerobiosis (Shel Lab ® SMI7-Doral, FL 33152-USA) por 48 h a 37°C, con posterior recuento de colonias en placa por duplicado, expresando los resultados en UFC/g en base seca, según la metodología propuesta por Rodríguez et al11.
Con los datos obtenidos se calculó el porcentaje de viabilidad de acuerdo con la Ecuación 1.
Donde:
N: número de células viables por gramo de material encapsulado.
No: número de células viables por gramo de materia seca antes del secado.
La eficiencia se determinó por la metodología de Rodríguez et al.,11 y Gonzáles et al12. Para ello se tomaron 2 g de material encapsulado y se diluyeron en 18 mL de agua destilada; la mezcla se llevó a centrífuga Harmle Z 326 K (Nürnberg-Alemania), a 5000 rpm por 15 min a 20°C, con el fin de extraer las células libres de L. plantarum. Luego se determinó la concentración bacteriana en el sobrenadante y la eficiencia fue establecida mediante la Ecuación 211.
Donde
A: Concentración bacteriana antes de la microencapsulación.
B: Concentración bacteriana después del microencapsulado.
Características físicas del microencapsulado
Se evaluaron los parámetros humedad, actividad de agua, solubilidad y humectabilidad de acuerdo con Rodríguez et al11. Para la humedad se tomaron 2 g de material microencapsulado y se depositaron en el equipo Kern DBS 60-3 (Balingen-Alemania) a una temperatura de 105°C con resolución de 0,001 g y el porcentaje se expresó en base seca. La actividad de agua se determinó en el equipo Termo higrómetro Hygrolab Rotronic (Nürnberg-Alemania) con 2 g de microencapsulado, el resultado se expresó en porcentaje de base seca. Para determinar la solubilidad se disolvió 1 g de microencapsulado en 100 mL de agua destilada, solución que estuvo 5 min a 30 ± 2°C en incubadora, luego se centrifugó a 3.000 rpm durante 5 min, posteriormente se tomaron 35 mL de sobrenadante y se transfirieron a una caja de Petri, previamente pesada. La caja se llevó a estufa a 105°C por 5 h hasta obtener un peso constante. Los sólidos obtenidos de la estufa se pesaron (mf) y se determinó el porcentaje de solubilidad con la Ecuación 311.
Donde:
mi: 0,25g = (1g/100mL = 0,01g/mL * 25mL de líquido sobrenadante).
mf: peso final de la muestra.
La humectabilidad se determinó de acuerdo con Figueroa et al.,13 y Rodríguez et al.,11 teniendo en cuenta las condiciones propias del laboratorio. Se utilizó un vaso de precipitado con 100 mL de agua destilada a 20°C y dimensiones de 5x7 cm. Posteriormente, se tomó 1 g de microencapsulado y se colocó en un porta objetos; este se situó sobre el vaso de precipitado y de manera suave se fue depositando el contenido en agua. La humectabilidad se determinó mediante el tiempo transcurrido del contacto con el agua y la inmersión completa del gramo de muestra.
Morfología y tamaño de microcápsulas
Se tomaron muestras del microencapsulado, que fueron enviadas al Centro de Microscopia y Análisis de la Universidad Nacional de Colombia para realizar fotografías mediante microscopia electrónica de barrido y así determinar la forma y el tamaño de la microcápsula. La morfología y tamaño de las microcápsulas fueron determinadas mediante un Microscopio Electrónico de Barrido FEG (Field Emission Gun) QUANTA 650 FEG. Para ello, las muestras se colocaron sobre stabs metálicos con cinta adhesiva de carbón, se recubrieron con oro en un equipo de recubrimiento Quorum 150ES. Las imágenes fueron tomadas con las siguientes características: alto vacío; voltaje de aceleración 10kV; detector para imágenes: Electrones secundarios (SE): everhart thornley detector ETD.
Evaluación in vivo del microencapsulado
Inoculación del alimento. La siembra se realizó previo establecimiento de la carga microbiana encontrada en la fase exponencial de crecimiento, inoculando el alimento balanceado en una relación de 20% p/v, se homogenizó y se llevó a incubación a 37°C durante 24 h. Al final, el alimento se conservó en bolsas plásticas de cierre hermético a temperatura ambiente. En adición, se usó un probiótico comercial como uno de los testigos y para ello se inoculó en el alimento de acuerdo con las instrucciones de la casa comercial.
Procedimiento in vivo-Modelo aviar
Se realizó en 240 pollos machos Ross 308 AP de un día de nacidos, con un peso aproximado de 41 g. Los animales se alojaron en 12 jaulas con capacidad para 20 aves. El manejo fue realizado según las recomendaciones de la casa genética según lo recomendado por Mottet y Tempio14. Las aves se acostumbraron a la ración durante los 6 primeros días y el experimento se realizó de los 7 a 35 días de edad. Las características del alimento balanceado fueron las siguientes: alimento tipo pollo campesino de una marca comercial reconocida. Este concentrado se caracteriza por no tener aditivos como anticoccidiales ni promotores de crecimiento, con un contenido de proteína cruda del 13%, grasa del 2%, una humedad máxima del 13%, fibra del 13% y un contenido de ceniza máximo del 10%. Y alimento balanceado con antibióticos y anticoccidiales con un contenido de proteína cruda del 12%, grasa del 2,5%, una humedad máxima del 12%, fibra del 8% y un contenido de ceniza máximo del 8%. La alimentación de las aves se realizó en dos tiempos (mañana y tarde). En la alimentación de la mañana se suministró el probiótico en sus dos formas (microencapsulado y sin microencapsular, es decir, por aspersión), y en la tarde sólo la ración de concentrado respectivo sin microorganismos manejando ad libitum, para así permitir la expresión libre del consumo y de la ganancia de peso en los diferentes grupos.
Los animales se distribuyeron de forma aleatoria en cuatro tratamientos. El primero se alimentó con dieta comercial sin aditivos, línea campesina sin aditivos como anticoccidiales ni promotores de crecimiento (T0); el segundo, dieta comercial con probiótico comercial (T1); el tercero, dieta comercial con inclusión de L. plantarum microencapsulado (T2); y el cuarto, dieta comercial con inclusión de L. plantarum sin microencapsular (T3). El alimento y agua fueron suministrados de forma ad libitum.
Morfología gastrointestinal
Al terminar el periodo de estudio (a los 35 días de edad del animal), se sacrificaron 10 aves por grupo, las cuales fueron seleccionadas de manera aleatoria. Se efectuó la disección y extracción del intestino delgado, se identificó la sección anatómica para localizar los órganos al momento de la evaluación microscópica siguiendo la técnica de necropsia aviar, estandarizada por Senne et al.15. Se tomaron 6 muestras por tratamiento, de las cuales dos se utilizaron para marcadores inmunológicos; dos para microscopia electrónica; y dos para histología. Las muestras se almacenaron por 24 h en recipientes plásticos rotulados que contenían formol tamponado al 10%. Luego de la fijación el patólogo veterinario realizó cortes del tejido seleccionado y obtenido de las necropsias (6 segmentos, intestino delgado), ubicaron en cassettes para inclusión de tejidos debidamente rotulados y se almacenaron en recipientes con formol buferado al 10%. Seguidamente se procesaron mediante la técnica de inclusión en parafina y coloración de Hematoxilina y Eosina (H/E)16.
Tinciones diferenciales
La producción de mucina intestinal se determinó mediante tinción de las células caliciformes con Azul de Alcian. Las muestras se procesaron por los métodos de rutina para microscopia de luz (Nikon, Serie ECLIPSE 80i, Japón) y las secciones histológicas (3-4 μm de grosor) se colorearon con Azul de Alcian ajustada a un pH de 3,0. La cuantificación de células productoras de IgA se realizó mediante la técnica de inmunohistoquímica16, determinando el número de células en 2,37 mm2 de GALTT. Los tejidos se observaron en objetivo 40X con microscopio Nikon Eclipse 80i, camera infinity y el software Image Pro Plus 5.0 software (Media Cybernetics, Silver Spring, MD, USA).
Respuesta post vacunal
Se evaluaron las vacunas de Gumboro, Newcastle y Bronquitis, que se administraron a los pollos el día 1 de vida. Al final del periodo de evaluación (35 d) se tomaron muestras de sangre de la vena ala (2 a 3 mL por ave) tomadas con aguja calibre 20 a 22 de ½ a 1 pulgada, usando jeringas desechables de 3 a 5 c.c. Durante el sacrificio, se separó el suero, se congeló y se envió las muestras al laboratorio Pronavícola. Los sueros se evaluaron por la técnica de Inmunohemaglutinación (New Castle, bronquitis) mediante el lavado de glóbulos rojos del pollo, para esto se colocaron de 3 a 5 mL de sangre con solución de Alsever en un volumen 1:1 en un tubo de ensayo de 10 mL, completándose con PBS (buffer fosfato salino), luego se centrifugó (10 min/1.800 rpm) en la centrífuga universal marca Hermle, serie Z 216 M, marca alemana y se extrajo el sobrenadante y Elisa (Gumboro) que se caracteriza por ser un ensayo inmunoenzimático utilizado comúnmente en la detección de un Antígeno (Ag) inmovilizado sobre una fase sólida, empleando Anticuerpos (Ac); esto quiere decir que se basa en el reconocimiento específico de antígeno-anticuerpo conjugado a una enzima, cuyo producto de reacción da lugar a un complejo coloreado llamado cromóforo que se cuantifica en un lector de ELISA mediante un método científico llamado espectrofotometría, utilizado para medir la cantidad de luz que absorbe una sustancia química cuando un haz de luz pasa a través de la muestra, usando un equipo de origen chino, marca BIOBASE, serie ELISA3. De esta manera, se determina la duración de la vacuna durante el periodo productivo, es decir, la persistencia de los anticuerpos en los diferentes grupos de estudio.
Exclusión competitiva
Se determinó el número de microorganismos en los medios Agar MRS para Bacterias Ácido Lácticas (BAL) y petrifilm (3M, Minessota, EEUU) para Escherichia coli y coliformes. El conteo se realizó de acuerdo con la técnica de diluciones seriadas y siembra en placa17. De esta manera, se tomaron cuatro pollos de un día del mismo lote del grupo recibido para la investigación, con el fin de verificar si el pollo trae o no microbiota en su sistema digestivo. Al final del ensayo se realizó este mismo procedimiento con 2 animales por réplica, para verificar y cuantificar la implantación del lactobacilo y la presencia y cantidad (UFC/mL) de E. coli y coliformes.
Análisis estadístico
Las variables se evaluaron mediante técnicas descriptivas y un diseño completamente aleatorizado con cuatro tratamientos, tres réplicas por tratamiento y 20 aves por réplica. El análisis de la información se realizó en el paquete estadístico SPSS (Wagner)18.
Consideraciones éticas
Para realizar el presente estudio, se tuvo en cuenta los principios de ética biomédica descritos por Beauchamp19, a saber: respeto de la autonomía, beneficencia, no maleficencia y justicia. Para la manipulación de los animales del estudio, se tuvo en cuenta los protocolos establecidos para la cría industrial de aves de engorde, proporcionándoles el ambiente y la alimentación necesaria para poder observar su rendimiento zootécnico. El probiótico se consideró como aditivo para su incorporación en el alimento con el mínimo de efecto perjudicial para el animal. También se consideró la “Guía para el cuidado y uso de animales de laboratorio (2011)” y la normatividad nacional vigente: Resolución 008430 de 1993 del Ministerio de Salud Colombiano, y la Ley 84 de 1989 que contempla los lineamientos para el uso de animales vivos en experimentos e investigación, así como el sacrificio de animales y la crueldad para con los animales. El sacrificio de los animales se realizó mediante el método establecido para el beneficio de aves, por aturdimiento y dislocamiento cervical, proceso que no genera sufrimiento en las aves.
Resultados
Los parámetros para la evaluación del proceso de microencapsulado de L. plantarum se pueden observar en la Tabla 1. Se encontró una viabilidad del 88,1%, una eficiencia alta (92,9%) y una excelente solubilidad (98,3%).
Tabla 1. Evaluación de la efectividad de la microencapsulación de L. plantarum
| Factor | Valor |
|---|---|
| Viabilidad (22 d) | 88,1% |
| Eficiencia (22 d) | 92,9% |
| Humedad relativa | 5,26% |
| Actividad de agua | 0,33 |
| Humectabilidad | 1 h, 28 min |
| Solubilidad | 98,3% |
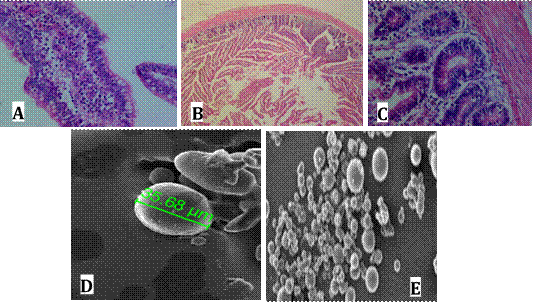
Los resultados para el tamaño y forma del microencapsulado se pueden observar en la Figura 2. Se obtuvo tamaños de microcápsulas entre los 15,18 a 35,68 µm con un promedio de 26 y coeficiente de variación del 26%. La forma del microencapsulado fue esférica. La humedad relativa encontrada 5,26%, que influye en el tamaño del microencapsulado y evita la contaminación bacteriana y micóticas. Por tanto una humedad relativa junto con la actividad del agua (0,33), bajas, mejora la supervivencia de la bacteria microencapsulada. Los resultados microbiológicos y tinciones especiales (inmunohistoquímica y Azul de Alcian) se pueden observar en la Tabla 2.
Se observó valores significativamente más altos del género Lactobacillus en el tratamiento T2, comparado con los tratamientos T3 y el control T0, sin ser significativo el conteo de (UFC/mL) frente al tratamiento que incluyo probiótico en la dieta comercial (T1). No se detectó presencia de E. coli en ninguno de los tratamientos. Se encontró mayor número de coliformes totales en el tratamiento To, sin embargo la mayor abundancia de Lactobacillus en el tratamiento T2 confirió beneficios intestinales que se pueden evidenciar en una proporción significativamente mayor de Lactobacillus/Coliformes (8225,23) para T2 que la encontrada en los tratamientos T3 (1679,59); T1 (17,86) y el control T0 (96,03) (Tabla 2).
Se encontró que los conteos de células por inmunohistoquímica como marcador de producción de IgA secretora para el tratamiento T2, dieta con L. plantarum microencapsulado, fue mayor al encontrado en los tratamientos T3; T1 y el control T0, sin ser estas diferencias significativas. Para el contéo de células por Azul de Alcian, se observó un conteo de caliciformes como marcador de la producción de mucinas, significativamente más alto en el tratamiento T0, comparado con los tratamientos: dieta comercial con probiótico comercial (T1), dieta comercial con inclusión de L. plantarum microencapsulado (T2) y dieta comercial con inclusión de L. plantarum sin microencapsular (T3), (p<0,05), (Tabla 2).
Estos resultados evidencian procesos inflamatorios en el grupo de tratamiento, dieta comercial sin aditivos (T0), en tanto los hallazgos observados en histología de su tejido intestinal como infiltración linfocitaria, enteritis necrótica, hiperplasia de células caliciformes y fusión de vellosidades, lo confirman, Figura 1D, 1E y 1C. Estas observaciones indican procesos inflamatorios acompañados de hiper producción de moco o mucinas que en su conjunto describen alteraciones patológicas en el tratamiento T0, Figura 1D, 1E y 1C; (Tabla 2).
Para las enfermedades de NewCastle, Gumboro y Bronquitis los títulos de anticuerpos IgG, pos vacunación fueron significativamente mayores para los tratamientos con L. plantarum (T2 y T3) (Figura 1A, 1B y 1C respectivamente).
En la Figura 2A, 2B y 2C se observan los hallazgos histopatológicos encontrados mediante las tinciones. Se identificó lesiones entero necróticas (EN) en todos los tratamientos, sin embargo, el tratamiento T3 (L. plantarum sin microencapsular) presentó estas lesiones en el 100% de las muestras. La atrofia de vellosidades (AV) no se presentó en el control (T0), pero sí en los demás tratamientos, con un valor muy elevado en el tratamiento T3. La fusión de vellosidades (FV) y el conteo de caliciformes fueron mayores en el tratamiento T3. Las lesiones más representativas están en el tejido de las aves que fueron alimentadas con L. plantarum, lo que indica que se deben completar los estudios en la cantidad suministrada y el ajuste del inóculo agregado en el alimento de los pollos.
Tabla 2. Parámetros microbiológicos e histoquímicos en pollos de engorde Ross, según tratamientos
| Parámetros microbiológicos | ||||
|---|---|---|---|---|
| Variable | T0 | T1 | T2 | T3 |
| Lactobacillus (UFC/mL) | 9,18x104c | 8,91x105b | 9,13x105a | 8,23x105b |
| E. coli (UFC/mL) | 0 | 0 | 0 | 0 |
| Coliformes totales (UFC/mL) | 9,56x102b | 4,99x104c | 1,11x102a | 4,9x102a |
| Proporción Lactobacillus/Coliformes | 96,03 | 17,86 | 8225,23 | 1679,59 |
| Conteo de células según tratamientos | ||||
| Inmunohistoquímica (células marcadas para IgA) | 375a | 370a | 390a | 383a |
| Caliciformes Azul de Alcian (células teñidas) | 1669a | 1110b | 1461c | 1372c |
T0: dieta comercial sin aditivos, T1: dieta comercial con probiótico comercial, T2: dieta comercial con inclusión de L. plantarum microencapsulado, T3: dieta comercial con inclusión de L. plantarum sin microencapsular. Letras distintas en la fila muestra diferencias significativas, (p<0,05).
Figura 1. Títulos de anticuerpos para las vacunas.
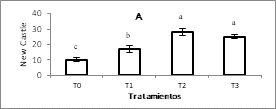
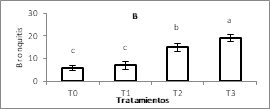
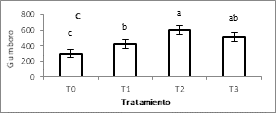
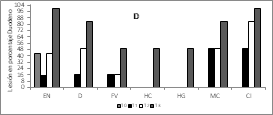
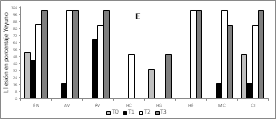
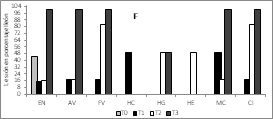
Figura 2. Histología del tratamiento con L. plantarum microencapsulado, según lesiones de intestino de pollos y microfotográfia del encapsulado.
Discusión
La viabilidad encontrada (83,1%) indica que es posible recuperar in vivo un alto número de células o colonias en medio de cultivo de la especie L. plantarum, luego del suministro del alimento al grupo de tratamiento de pollos suplementados con dieta comercial y adición de L. plantarum microencapsulado, en concordancia con lo encontrado en un estudio similar reportado por Sinsajoa et al.,20 quienes obtuvieron un (83,3%) de viabilidad. Estos resultados permiten confirmar que la conservación de la cepa es efectiva mediante la técnica de microencapsulación por secado por aspersión. La humedad relativa encontrada 5,26%, influye en el tamaño del microencapsulado y evita la contaminación bacteriana y micótica. Por tanto una humedad relativa junto con la actividad del agua (0,33), bajas, mejora la supervivencia de la bacteria microencapsulada. Sin embargo, los resultados de la eficiencia fueron limitados, esto puede ser consecuencia posiblemente del proceso de elaboración del microencapsulado. De acuerdo con Ramos et al.,21 esta variable está afectada por factores como la temperatura, humedad y la presión, lo que puede indicar problemas en el proceso de elaboración del microencapsulado.
En las variables físicas del microencapsulado, se encontró que los valores de actividad de agua (aw), humectabilidad y solubilidad están entre lo observado por diferentes reportes22-24, que muestra lo adecuado de la técnica para estos parámetros. Sin embargo, la humedad es mayor a lo sugerido por Samedi y Charles25, para secado por aspersión (3,5 a 4,0%), sin afectar valores esperados de variables de interés como la viabilidad. La forma y tamaño del microencapsulado tuvieron un tamaño adecuado, dado que Rodríguez y Jiménez26, señalan que el tamaño debe estar entre 6,4 y 120 µm para mantener la viabilidad y conservación de la cepa. Esta investigación encontró valores significativamente más altos (UFC/mL) del género Lactobacillus en el tracto intestinal de los pollos tratados con dieta comercial con inclusión de L. plantarum microencapsulado, traduciéndose en una mayor abundancia de estos microorganismos benéficos, comparado con los tratamientos, dieta comercial con inclusión de L. plantarum sin microencapsular, dieta comercial con probiótico comercial, y dieta comercial sin aditivos.
Un hallazgo que se deriva de la discusión anterior relacionado a que la mayor abundancia de Lactobacillus se encontró en el tratamiento con adición en el alimento para pollos Ros de L. plantarum microencapsulado, se traduce en beneficios intestinales que se pueden evidenciar en una proporción significativamente mayor de Lactobacillus/Coliformes en este grupo, que la encontrada en los tratamientos dieta comercial con inclusión de L. plantarum sin microencapsular, dieta comercial con probiótico comercial, y dieta comercial sin aditivos (Tabla 2). Hallazgo que posibilita la sustitución de los APC por L. plantarum microencapsulado adicionado a la dieta básica de los pollos de engorde y resolver problemas de salud pública asociados a la alteración de la microbiota normal intestinal humana concomitante con la disminución de la selección positiva de bacterias resistentes a los APC4,5.
Esto último se ha convertido en un problema de salud pública, dado que la producción de pollo es el primer eslabón de la cadena productiva, derivando en la transmisión de microorganismos y trazas de antibióticos como también detritus metabólicos que afectan la salud humana del consumidor final6.
Algunos estudios demuestran efectos positivos de las bacterias ácido lácticas y su potencial como agentes moduladores de la microbiota normal del tracto digestivo y su consiguiente salud intestinal, lo que indica que pueden convertirse en una alternativa a los APC y aportar en la solución de problemas prioritarios de salud pública derivados de la ingesta de pollo considerada como la principal carne de consumo humano8.
Se encontró que los conteos de células por inmunohistoquímica como marcador de producción de IgA secretora para el tratamiento T2, dieta con L. plantarum microencapsulado, fue mayor al encontrado en los tratamientos dieta comercial con inclusión de L. plantarum sin microencapsular, dieta comercial con probiótico comercial, y dieta comercial sin aditivos. Para el conteo de células por Azul de Alcian, se observó un conteo de caliciformes como marcador de la producción de mucinas, significativamente más alto en el tratamiento control, dieta comercial sin aditivos comparado con los tratamientos: dieta comercial con probiótico comercial (T1), dieta comercial con inclusión de L. plantarum microencapsulado (T2) y dieta comercial con inclusión de L. plantarum sin microencapsular (Tabla 2). Estos resultados evidencian procesos inflamatorios en el grupo de tratamiento dieta comercial sin aditivos (T0), en tanto los hallazgos observados en histología de su tejido intestinal como infiltración linfocitaria, enteritis necrótica, hiperplasia de células caliciformes y fusión de vellosidades, lo confirman, Figura 1D, 1E y 1C. Estas observaciones indican procesos inflamatorios acompañados de hiper producción de moco o mucinas que en su conjunto describen alteraciones patológicas en el tratamiento, dieta comercial sin aditivos.
Algunas limitaciones del presente estudio se refieren a alteraciones histopatológicas en los tratamientos con suministro de L. plantarum. Es posible que la posología y la densidad celular de los inóculos de la bacteria láctica podrían estar asociadas a las lesiones en el tracto gastrointestinal de las aves. En la literatura se ha encontrado que los probióticos en condiciones inadecuadas pueden tener efectos indeseables en el huésped, como la presencia de alteraciones en la mucosa gástrica por un elevado crecimiento bacteriano27.
La enteritis necrótica en pollos se relaciona con infección por Clostridium perfringens28-32. Este tipo de lesión se encontró con mayor porcentaje en el T3, al igual que muerte celular y cambios inflamatorios. Por otra parte, la enteritis necrótica se ha correlacionado con la presencia de otras enfermedades infecciosas, tal como coccidiosis y enfermedad de la bursa29,30. Esto es importante para las aves porque representa un mayor equilibrio en la microbiota gastrointestinal como consecuencia del antagonismo con microorganismos patógenos31.
Los resultados indican un buen estatus sanitario de los animales, pudiéndose establecer una correlación con el mayor número de lactobacilos en algunos tratamientos, en especial dieta comercial con adición de L. plantarum microencapsulado y en la abundancia relativa de bacterias benéficas en la microbiota gástrica de este grupo de aves. Por otra parte, la variable coliformes totales tuvo mayor porcentaje en el tratamiento T1 (probiótico comercial), lo que indica que el contenido nutricional del producto comercial permite un incremento de la población microbiana de los animales32.
Se evidenció en los tratamientos con las cepas lácticas T2 y T3, un estímulo sobre el sistema inmune, que posiblemente podría mejorar la productividad del pollo de engorde. Al respecto, Rioux et al.33, hallaron un aumento de la seroconversión ante el antígeno postvacunal en sangre con la adición de L. casei en la dieta de pollos de engorde, lo que concuerda con los hallazgos de esta investigación. Esto demuestra la efectividad de los tratamientos T2 y T3, L. plantarum microencapsulado y sin microencapsular para inducir y mantener por un mayor tiempo altos títulos de anticuerpos (IgA secretora) pos vacunales en la vida productiva de las aves.
Conclusiones
La técnica de secado por aspersión es eficiente en la microencapsulación de la bacteria láctica. El suministro de L. plantarum microencapsulado en el alimento para pollos mejora parámetros inmunológicos y confiere mayor abundancia de bacterias benéficas presentes en la microbiota intestinal. L. plantarum microencapsulado induce y mantiene altos títulos de anticuerpos post vacunales en la vida productiva de las aves.
Se necesita continuar con la investigación en lo referente a dosis, vía de administración y frecuencia de suministro del probiótico, ya que se observó lesiones gastrointestinales posiblemente por un exceso de microorganismos en la alimentación.