Helicobacter pylori: Microorganismo patógeno o mutualista en poblaciones colombianas
Helicobacter pylori: Pathogenic or mutualistic microorganism in Colombian populations
Helicobacter pylori: microrganismo patógeno ou mutualista em populações Colombianas
Como citar: Guzmán KA, Pazos A. Helicobacter pylori: Microorganismo patógeno o mutualista en poblaciones colombianas. Univ Salud. 2023;25(1):A1-A6. DOI: https://doi.org/10.22267/rus.232501.292.
# Resumen
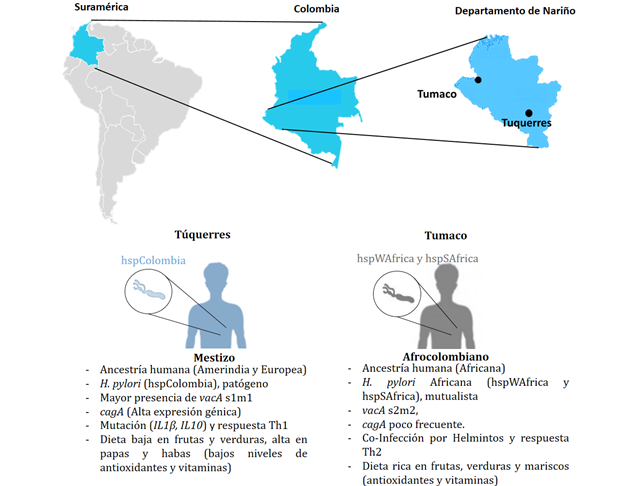
Introducción: El riesgo de desarrollar cáncer gástrico varía entre continentes, países y regiones. A pesar de que existe una alta prevalencia de Helicobacter pylori su rol como patógeno o mutualista define el riesgo de cáncer gástrico en las regiones de Colombia. Objetivo: Discutir el rol de Helicobacter pylori en el riesgo de cáncer gástrico en Colombia. Materiales y métodos: Revisión de literatura mediante la búsqueda, en las bases de datos LILACS, SciELO, PubMed. Resultados: La coevolución del humano y de Helicobacter pylori; la virulencia de genes cagA, vacA; el tipo de respuesta inmune inflamatoria a Helicobacter pylori (Th1) o antinflamatoria (Th2) y la susceptibilidad humana a cáncer gástrico (IL1β, IL10), junto a la dieta y factores ambientales explican el papel de Helicobacter pylori como patógeno o mutualista asociado al riesgo de cáncer gástrico en Colombia. Conclusiones: Helicobacter pylori tiene un rol mutualista principalmente en poblaciones de bajo riesgo de cáncer gástrico (costas), no obstante, en poblaciones con alto riesgo de cáncer gástrico (andes), su papel como patógeno amerita la erradicación; única estrategia para mitigar la alta incidencia de este cáncer en Colombia.
Palabras clave: Helicobacter pylori; incidencia, cáncer gástrico; factores de riesgo; coevolución.
# Abstract
Introduction: The risk to develop gastric cancer varies between continents, countries and regions. Although there is a high prevalence of Helicobater pylori, its role as either pathogen or mutualistic bacteria defines the risk of gastric cancer in Colombian regions. Objective: To discuss the role of Helicobacter pylori in the risk of gastric cancer in Colombia. Materials and methods: A literature review based on searching LILACS, SciELO, and PubMed databases. Results: Helicobacter pylori role as either a pathogen or mutualistic microorganism associated with gastric cancer risk in Colombia can be explained by analyzing elements such as: human and Helicobacter pylori coevolution; cagA and vacA gene virulence; inflammatory (Th1) or anti-inflammatory (Th2) responses induced by Helicobacter pylori; human susceptibility to gastric cancer (IL1β, IL10); diet; and environmental factors. Conclusions: Even though Helicobacter pylori has a mutualistic role in populations at low gastric cancer risk (coastal regions), its role as a pathogen in populations at higher risk (Andean regions) justifies its eradication as a key strategy to mitigate the incidence of this cancer in Colombia.
Keywords: Helicobacter pylori; incidence; Stomach Neoplasms; risk factors; biological coevolution.
# Resumo
Introdução: O risco de desenvolver câncer gástrico varia entre continentes, países e regiões. Embora haja uma alta prevalência de Helicobacter pylori, seu papel como patógeno ou mutualista define o risco de câncer gástrico nas regiões da Colômbia. Objetivo: Discutir o papel do Helicobacter pylori no risco de câncer gástrico na Colômbia. Materiais e métodos: Revisão da literatura por meio da busca, nas bases de dados LILACS, SciELO e PubMed. Resultados: A coevolução de humanos e Helicobacter pylori; a virulência dos genes cagA, vacA; o tipo de resposta imune inflamatória ao Helicobacter pylori (Th1) ou anti-inflamatório (Th2) e a suscetibilidade humana ao câncer gástrico (IL1β, IL10), juntamente com a dieta e fatores ambientais explicam o papel do Helicobacter pylori como patógeno ou mutualista associado ao risco de câncer gástrico na Colômbia. Conclusões: Helicobacter pylori tem um papel mutualista principalmente em populações de baixo risco de câncer gástrico (litoral), porém, em populações com alto risco de câncer gástrico (andes), seu papel como patógeno justifica a erradicação; única estratégia para mitigar a alta incidência deste câncer na Colômbia.
Palavras chave: Helicobacter pylori; incidência; neoplasias gástricas; fatores de risco; coevolução biológica.